高中 化学
-
(1) A、B、C 三种元素中第一电离能最小的元素是 (填元素符号),其基态原子核外电子排布为。
-
(2) C元素的单质可与Cl2反应生成CCl3 , 该分子为结构,是(填“极性分子”“非极性分子”),与水反应剧烈产生“白烟”,其方程式为。
-
(3) A、B两种元素可形成化合物X,写出X的电子式。
-
(4) A、C两种元素可形成化合物Y(C2A6),其中心原子的杂化方式为。
-
(5) A、.B、C三种元素组成的化合物Z(分子式为BCA4),该物质曾作为一种还原剂,这是由于A 的价态为。
-
(6) Z形成的晶体属于立方晶系,晶胞参数为apm,其晶体类型为,晶胞如下图所示(图中A原子被省略),在此晶胞中,含有个B原子。晶胞密度表达式为 g·cm-3 (用a和NA表示)。

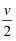 mL溶液稀释到2V mL,则稀释后溶液中SO42-的物质的量浓度是( )
mL溶液稀释到2V mL,则稀释后溶液中SO42-的物质的量浓度是( )
 mol·L-1
B .
mol·L-1
B .  mol·L-1
C .
mol·L-1
C .  mol·L-1
D .
mol·L-1
D .  mol·L-1
mol·L-1

-
(1) 利用上图装置研究铜与浓硫酸反应,反应化学方程式为;B装置的目的是;x溶液为。
-
(2) 将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为,气体产生越来越快的原因可能是(至少两点)。验证该气体的实验方案如下:

①装置连接顺序:x→;
②能证明上述假设成立的实验现象是。
-
(3) 取少量镁粉加入盛浓硫酸的烧杯,在通风橱中实验。充分反应后溶液中有灰白色悬浮物,设计方案研究该悬浮物的组成,请帮助完善。(假设镁的化合物都溶于稀酸)

写出产生该灰白色悬浮物主要反应的化学方程式。
据国外资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号应位于周期表中的 ( )
A.第六周期ⅣA族 B.第七周期ⅥA族
C.第七周期Ⅷ族 D.第八周期ⅥA族
NA代表阿伏加德罗常数的值。下列有关叙述正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B.2.3g钠被O2完全氧化时,钠得到的电子数目为0.1NA
C.9.2 g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移电子数为0.6NA
D.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10−9NA
第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,下列有关“类钫”的预测中错误的是( )
A.单质有较高熔点 B.“类钫”在化合物中呈+1价
C.“类钫”具有放射性 D.“类钫”单质的密度大于1 g·cm-3
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是周期第族,其单质可采用电解熔融的方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是,碱性最强的是。(填化学式)
(3)气体分子(mn)2的电子式为。(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为。
下列说法正确的是(NA为阿伏加德罗常数) ( )
A.124 g P4含有P—P键的个数为4NA
B.18 g NH4+中含有N—H键键长和键能均相同,且个数为4NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:

(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体B.吸收氯气C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将lmolCH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
下列说法正确的是
A.福尔马林能使蛋白质发生变性,可用于浸制动物标本
B.花生油和润滑油均含不饱和脂肪酸酯,它们都属于高分子化合物
C.用灼烧法可区分蚕丝和人造纤维,有烧焦羽毛味的为人造纤维
D.往含硫酸的淀粉水解液中加银氨溶液并水浴加热,检验淀粉是否水解
下列说法正确的是 ( )
A.难溶电解质的溶度积越小,溶解度越大 B.可以通过沉淀反应使杂质离子浓度为0
C.难溶电解质的溶解平衡是一种静态平衡 D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2
下列关于镁和钠的比较,结论正确的是
A.铝镁合金的硬度较大,钠钾合金的硬度较小
B.因为钠的金属性比镁要强,所以钠的熔点比镁要高
C.镁能置换硫酸铜中的铜,钠也能置换硫酸铜中的铜
D.在空气中都能被点燃,生成的产物都是氧化物
下列物质中不与二氧化硅反应的是( )
A.烧碱 B.氢氟酸 C.硝酸 D.生石灰
下图表示反应X(g)![]() 4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是( )
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是( )

A. 第6min后,反应就终止了 B. 若降低温度,v正和v逆将以同样倍数减小
C. X的平衡转化率为85% D. 若升高温度,X的平衡转化率将大于85%
化学与生产、生活、环境密切相关。下列有关说法正确的是
A.硅太阳能电池与原电池的原理相同
B.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
C.工业上海水提镁涉及的一系列反应都是氧化还原反应
D.聚乙烯塑料是通过加聚反应制得的
下列分子式表示的物质一定是纯净物的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
下列溶液中加入铁粉,不能发生化学反应的是
A. NaHCO3 B. FeCl3 C. CuSO4 D. NaHSO4
常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中能大量共存的一组离子正确的是( )
A.加入过量NaOH溶液:Na+、AlO2-、OH-、SO42-
B.加入过量氨水:NH4+、Al3+、OH-、SO42-
C.通入过量Cl2:Fe2+、Na+、Cl-、SO42-
D.通入过量SO2:Fe2+、H+、SO32-、SO42-
- 一家商店将某种服装按成本价提高40%后标价,又以8折(即按标价的80%)优惠卖出,结果每件作服装仍可获利15元,则这种服
- 下列选项中物质的俗名、用途、化学式、类别完全对应正确的是________ 选项 俗名 用途 化学式 类别 A 食盐 除
- Singapore’s public transport system (公共交通系统) is one of the b
- 9.汉初,王国内群臣史民对诸侯王自称“臣”,且朝廷官史对诸侯王也可以自称“臣”。汉武帝时,颁布法令严格禁止诸侯王与朝廷官
- 下列各组词语中,加点字的读音完全正确的一组是 ( ) A.栖息(qī)鸟窠(kē)猝然(chù) 饿殍遍野(piáo)
- 已知:在△AOB中,AB=,OB=6,∠B=45°,以O为原点,所在直线为x轴建立直角坐标系 (1)写出点A的坐标:;
- 下列装置或操作能达到实验目的的是A.分离水和CCl4 B.定容 C.比较两种盐的热稳定性 D.构成铜锌原电池
- 如图1-17,已知= =,则下列各式中正确的是()图1-17A. =
- 如图,已知二次函数图象的顶点坐标为(2,0),直线y=x+1与二次函数的图象交于A,B两点,其中点A在y轴上. (1)二
- 我们身边常见的下列物质中,属于氧化物的是( ) A.氧气 B.水 C
- 一束光射到平面镜上,入射角是30°,则反射光线与入射光线的夹角 是____ 度;如果这束光垂直射到平面镜上,这时入射角是
- (本题满分8分)为了进一步了解某校九年级学生的身体素质情况,体育老师对该校九年级(1)班50位学生进行一分钟跳绳次数测试
- 下列各项中a、b、c、d代表的结构正确的是 ()A.a—质粒RNA B.b—限制性外切酶 C.c—R
- 2009年3月,十一届全国人大二次会议听取《政府工作报告》《最高人民法院工作报告》《最高人民检察院工作报告》等。全国人大
- 玻璃的主要成分之一是二氧化硅。能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是() A.烧碱
- 在噬菌体侵染细菌的实验中,下列对噬菌体衣壳蛋白质合成的描述,正确的是( ) A.氨基酸原料和酶来自细菌
- 下列离子方程式中,正确的是() A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ B. 氯气与氯化亚铁溶液反应:
- Who would you rather ________ the watch? A. have to repair
- 《汉唐间史学的发展》一书说:“政治上结束战国是在秦代,而文化上结束战国却是在汉代……”“文化上结束战国却是在汉代”指(
- 由于“赤潮”的影响,一条4Kg重的杂食性海洋鱼死亡,假如该杂食性的食物有1/2来自植物,1/4来自草食鱼类,1/4来自以



