高中 化学
 eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( ) 
选项 | 实验 | 现象 | 结论 |
A | CO2通入Na2SiO3溶液中 | 白色浑浊 | C的非金属性强于Si |
B | 常温下将Al片放入浓硝酸中 | 无明显现象 | 常温下Al与浓硝酸不反应 |
C | 将干燥的Cl2通过有色鲜花 | 鲜花褪色 | Cl2有漂白性 |
D | BaSO4悬浊液静置后,取上层清液滴入Na2CO3浓溶液 | 有白色沉淀生成 | KSP (BaSO4)<KSP (BaCO3) |

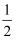 N2(g)+
N2(g)+  H2(g)═NH3(l);△H=(b+c﹣a)kJ•mol﹣1
D .
H2(g)═NH3(l);△H=(b+c﹣a)kJ•mol﹣1
D . 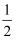 N2(g)+
N2(g)+  H2(g)═NH3(g);△H=(a+b)kJ•mol﹣1
H2(g)═NH3(g);△H=(a+b)kJ•mol﹣1
-
(1) 如图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。

①下列说法正确的是(填字母序号)
A.固氮过程中,N2只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子。请将该反应的离子方程式补充完整:5CH3OH+□NO3-
 □( )+□( )+□( )+□( ),
□( )+□( )+□( )+□( ), -
(2) 研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。
①已知:SO2生成SO3总反应方程式是2SO2(g)+O2(g)
 2SO3(g)ΔH=-196.6kJ/mol
2SO3(g)ΔH=-196.6kJ/mol此反应可通过如下两步完成:2NO(g)+O2(g)
 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/molNO2(g)+SO2(g)
 SO3(g)+NO(g)ΔH2=。
SO3(g)+NO(g)ΔH2=。②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是。
-
(3) 砷(As)是第四周期ⅤA族元素,其化合物,有着广泛的用途。
①AsH3的稳定性比NH3的稳定性(填“强’’或“弱’’)。用原子结构解释原因。
②常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式。
③298K时,将20mL3xmol•L-1Na3AsO3、20mL3xmol•L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-
 AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为。
 相同的是()
相同的是()

 、
、  均减小,反应速率加快
均减小,反应速率加快
取铜镁合金14.4g完全溶于一定浓度的硝酸中,反应过程中硝酸的还原产物只有2.24LNO2和4.48LNO气体(气体体积都已折算成标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀的质量为
A.22.4g B.26.3g C.28.5g D.30.0g
如图所示,向一定量的铁粉中加入一定体积12 mol·L-1 的HNO3,加热充分反应后,下列微粒在体系中一定大量存在的是( )

①NO![]() ②Fe3+ ③H+ ④NO
②Fe3+ ③H+ ④NO
⑤NO2
A.① B.①⑤
C.②④⑤ D.①②③⑤
同温同压下,等体积的 

A . 质量比为 11 : 16 B . 密度比为 11 : 16
C . 物质的量比为 16 : 11 D . 分子个数比为 1 : 1
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是____________________________________________________。
(2)混合气体的平均摩尔质量是____________________________________________。
(3)CO2和CO的体积之比是______________________________________________。
(4)CO的体积分数是____________________________________________________。
(5)CO2和CO的质量之比是______________________________________________。
(6)CO的质量分数是____________________________________________________。
(7)混合气体中所含氧原子的物质的量是___________________________________。
(8)混合气体中所含碳原子的物质的量是___________________________________。
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br﹣,然后Br+首先与CH2=CH一端碳原子结合,第二步才是Br﹣与另一端碳原子结合,根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是( )
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
在同温同压条件下,分子数相同的任意两种气体,它们的()
A.体积都是22.4L
B.密度相同
C.所占体积相同
D.原子数目相同
某混合溶液中,含溶质X、Y 各0.1mol,向其中滴加 0.1mol/L的Z 溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z 分别是

A.偏铝酸钠、氯化钡、硫酸 B.偏铝酸钠、氢氧化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠 D.氯化铝、氯化镁、氢氧化钠
- 如图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题:(1)在C图中将相关粒子图形补充完整(用表示氢原子,
- 4.一鹭图 刘羽芳草垂杨荫碧流,雪衣公子立芳洲。一生清意无人识,独向斜阳叹白头。【小题1】作者运用哪些手法刻画白鹭的?(
- 如图,是一个算法的程序框图,该算法输出的结果是( ) A. B. C. D.
- 下图为某人的一个体细胞及其染色体组成示意图,据图判断下列叙述不正确的是A.染色体存在于细胞核内 B.体细胞中染色体是成对
- 初速为零的匀加速直线运动,在第3秒、第4秒内的总位移是1。2米,则第5秒内的位移是( )A、0.7米 B
- Oncethere was a very poor villager. He found it difficult ev
- 下列句子中没有语病的一项是:( )A.在一篇报道里,赵小东说,拥有同样的阳光、空气、水以及一切有益的东西,未必都能长
- Let’sthe matter until the next meeting,because it’s too late
- 毒蜂身上斑斓的花纹对天敌起到一种警示作用。这种信息的传递依靠下列哪一种因素() A.光 B.信息素 C.光敏色素 D.
- 日常生活中硫、氮氧化物的排放可能导致“酸雨”。下列活动会导致“酸雨”危害加剧 的是 A.种草植树,建设“海绵
- 依次填入下面一段文字横线处的语句,衔接最恰当的一组是鲁迅几百万字的遗著,其中很大一部分必将永远受到读者的喜爱,后世读者将
- (2013全国初中应用物理知识竞赛预赛题)如图l0所示,凸透镜的焦距为5厘米,在透镜左侧l0厘米处,有一个与主光轴垂直的
- 下列四个反应中,水起的作用与其它不相同的是 ① Cl2+H2O ②Na+H2O ③NO2+H2O
- 中华传统文化辉煌灿烂,被列为世界“四大圣人”这五的孔子的许多观点被西方世界称颂并吸收利用;《孙子兵法》也被日本人运用到商
- 设全集U={0,1,2,3,4},集合A={1,2},则UA等于( ) A.{0,3,4}
- 下列词语中加线的字,读音正确的一项是( ) A.酵母(xiào) 箴言(zhēn) 深邃(suì) 自怨自艾
- 在一鱼缸内的食物链中含量最多的生物是 () A.水蚤 B.藻类
- 如图所示,实线表示匀强电场的电场线。一个带正电荷的粒子以某一速度射入匀强电场,在电场力作用下,运动的轨迹如图中的虚线所示
- 设集合M={x|≥0},N={x|2x≥1},则M∩N=.
- 对南北朝石窟艺术的表述,最能体现当时社会发展特点的是( ) ①继承了秦汉以来的艺术传统



