高中 化学
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH3 | 21molNH3 | 41molNH3 |
NH3的浓度(mol.L﹣1) | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收akJ | 吸收ckJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | a1 | a2 | a3 |
-
(1) 98 %的浓硫酸的物质的量浓度为。
-
(2) 现有下列几种规格的量筒,应选用(填序号)。
①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒
-
(3) 实验需要以下步骤:
①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为。
-
(4) 下列操作使所配溶液的物质的量浓度偏高的是__________。A . 往容量瓶中转移溶液时有少量液体溅出 B . 未洗涤稀释浓H2SO4的小烧杯 C . 定容时俯视刻度线 D . 洗净容量瓶未干燥即用来配制溶液 E . 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
 )或-lgc(OH-)。T℃时CaWO4、Ca(OH)2的沉淀溶解平衡曲线如图所示,则下列说法正确的是( )
)或-lgc(OH-)。T℃时CaWO4、Ca(OH)2的沉淀溶解平衡曲线如图所示,则下列说法正确的是( )
 。在四种不同情况下测得的反应速率分别为:
。在四种不同情况下测得的反应速率分别为:① ②
②
③ ④
④
下列有关反应速率的比较中正确的是( )

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是( )

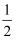 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
 B .
B .  C . 稀
C . 稀 D .
D . 
第3周期元素的原子,其最外层3p亚层上有一个未成对电子,它的最高价氧化物对应水化物的酸根离子可能是
A.RO5- B.RO3- ![]() RO42- D.RO4-
RO42- D.RO4-
在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是________(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是________(填化学式),反应的化学方程式为________________________________________________________________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有________(填序号)。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液____________,说明这种气体具有____________性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式为__________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?________(填“能”或“不能”),若不能,请填写两种能鉴别的试剂___________________________________。
(14分)I 选择下列实验方法分离物质,将分离方法的序号依次为
①分离水和四氯化碳的混合物;②分离氯化钾溶液和沙子的混合物;
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
④ 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
⑤分离食盐和碘的混合物; ⑥ 从碘水中提取碘单质。
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
II 、长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。

请回答:(1)写出B装置中反应的离子方程式
(2)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(3)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:

(4)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(5)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(6)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量Ba(NO3)2溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将滤液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
(2)已知:波长为300nm的紫外光的光子所具有的
能量约为399 kJ/mol。根据右表有关蛋白质分子中
重要化学键的信息,说明人体长时间照射紫外光后
皮肤易受伤害的原因:______________________________________________________________
_____________________________________________________________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中含有极性键的数目是___________ ;NH4+的空间构型是_______________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有8mol N-H键断裂,则形成的π键有________mol。
 (4)硼砂是含结晶水的四硼酸钠,其阴离子
(4)硼砂是含结晶水的四硼酸钠,其阴离子![]() (含B、O、H三种元素)的球棍模型如右图所示:
(含B、O、H三种元素)的球棍模型如右图所示:
①在![]() 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由![]() 、
、![]() 和
和![]() 构成,它们之间存在的作用力有 (填序号)。
构成,它们之间存在的作用力有 (填序号)。
A.共价键 B.离子键 C. 氢键 D.范德华力 E. 金属键
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1) 化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是 (用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U形管G的作用为 。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(右图中的△H表示生成1mol产物的数据)。
(1)P和Cl2反应生成PCl3的热化学方程式_____________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________________,
(3)P和Cl2分两步反应生成1molPCl5的
△H3=_________,P和Cl2一步反应生成1molPCl5的△H4__________△H3 (填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________。
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂 D.NaClO2和ClO2中Cl的化合价相同
- 下表反映了我国自然资源的特点是( )A自然资源总量丰富,人均不足 B自然资源十分匮乏 C自然资源丰富,品
- 请你观察下面的四个图形,它们体现了中华民族的传统文化.对称现象无处不在,其中可以看作是轴对称图形的有( )A.4个
- 北京奥运会游泳馆“水立方”内部材料主要由金属材料钢铁构成,外部材料聚氟乙烯属于 材料。为确保“水立方”的水质达
- 将打磨过的铁丝插入含有硝酸银和硝酸锌的混合溶液中,铁丝表面会覆盖一层物质,这层物质是 A.银和锌; B.银; C.锌;
- 兰州中山桥是黄河上游修建最早和唯一保存至今的近现代钢架桥梁,属于全国重点保护文物。为了提升这座已通行百年的铁桥抵御自然灾
- 化学与健康息息相关 (1)豆浆已成为众多家庭的早餐选择,下表是豆浆中一些成分的平均含量: 成分 水 蛋白质 脂肪 糖类
- 把参数方程(θ为参数)化为普通方程,结果是_______________.
- 曲线 在点 处的切线与坐标轴所围成的三角形的面积为( )
- “徜徉于山林泉石之间,而尘心渐息;夷犹于诗书图画之内,而俗气滞消。”这说明 A.要积极参加各种文化活动 B.文化
- 如题5图所示,飞机做特技表演时,常做俯冲拉起运动,此运动在最低点附近可看作是半径为500 m的圆周运动。若飞行员的质量为
- 地理信息系统 A.主要是记录地理事物的计算机系统 B.具有空间分析的能力,没有动态预测能力 C.是专门处理地理空间数据
- 唐代和宋代都有谏官。唐代谏官由宰相荐举,主要评议皇帝得失;宋代谏官由皇帝选拔,主要评议宰相是非。这说明 A.唐代君主的权
- 甲、乙两种非金属:①甲比乙容易与H2化合;②甲能与乙阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧
- 已知,与+1成正比例,与+1成反比例,当=0时,=-5;当=2时,=-7。 (1)求与的函数关系式; (2)当=5时,求
- 有学者把文字的发明作为文明出现的标志之一。作为史料,下列所选取的一组甲骨文主要反映了中国古代的( ) A.分封制
- 点从点出发,按逆时针方向沿周长为的图形运动一周,两点连线的距离与点走过的路程的函数关系如图,那么点所走的图形是
- 已知如图3所示,一列简谐横波在x轴上传播,轴上a、b两点相距12 m.t=0时a点为波峰.b点为波谷;t=0.5 s时,
- 庆历四年春,滕子京谪守巴陵郡。越明年,政通人和,百废具兴。乃重修岳阳楼,增其旧制,刻唐贤今人诗赋于其上。属予作丈以记之。
- —How do you usually go toschool? —I usuallygo to school ____
- 若双曲线的右焦点与抛物线的焦点重合,则该双曲线的离心率是 A. B.



