初中 化学
半导体硅(Si)晶片可用于制造计算机芯片。工业上通过二氧化硅与碳在一定条件下反应得到硅,该反应的微观过程如图所示,请结合图示回答:

-
(1) C属于(填“单质”或“氧化物”)。
-
(2) 该反应的符号表达式为
-
(3) 请你从上图中写出关于化学变化的一条信息
关于下列符号或图示的说法正确的是( )
①2H ②Al3+ ③  ④
④ 
A . ①表示2个氢分子
B . ②表示铝元素的化合价为+3价
C . ③表示镁原子的结构示意图
D . 由④可知铕的原子序数为63
下列关于元素的叙述中,正确的是 ( )
A . 同种原子的统称叫元素
B . 同种元素的原子结构和质量完全相同
C . 同种元素的种类取决于该元素原子的核外电子数
D . 不同种元素的根本区别是核内质子数不同
医疗上用的生理盐水是0.9%的氯化钠溶液.若在实验室配制0.9%的氯化钠溶液100g,下列配制过程正确的是( )
A . 用托盘天平称量0.9g氯化钠
B . 用量筒量取100g水
C . 把食盐倒入量筒中搅拌溶解
D . 用烧杯量取91g水
某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程,请回答:

-
(1) 步骤②反应的化学方程式为.
-
(2) 参考氢氧化钠和氢氧化钙的溶解度数据(如表所示),为得到相对纯净的氢氧化钠固体,步骤③所包含的具体操作有哪些?.

0
20
40
60
NaOH
42
109
129
174
Ca(OH)2
0.19
0.17
0.14
0.12
对于下列化学用语,有关说法错误的是( )
①CO2 ②Fe3+ ③KMnO4 ④  ⑤
⑤ 
A . ①表示的是两种元素组成的化合物
B . ④⑤表示的元素位于同一周期
C . ③中锰元素的化合价为+7 价
D . ②中数字的含义:一个铁离子带 3 个单位的正电荷
甲、乙两种物质的溶解度曲线如图所示.下列说法中正确的是( )

A . t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液
B . t2℃时,甲、乙饱和溶液的溶质质量分数都为30%
C . t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和
D . t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙
下列做法与“创建卫生城市,建设水绿盐城”不吻合的是( )
A . 植树种草
B . 就地焚烧垃圾
C . 节能减排
D . 公共场所禁止吸烟
我国科学家成功实现了用CO2合成醋酸,其反应的微观示意图如下。下列说法错误的是( )

A . 该反应属于化合反应
B . 反应前后保持不变的粒子是原子
C . CO2和醋酸可使紫色石蕊溶液变成红色
D . 为利用CO2提供了新的途径
向pH=3的盐酸溶液中加入(或通入)下列物质,混合后溶液的pH会减小的是( )
A . 蒸馏水
B . HCl气体
C . pH=3的稀硫酸
D . Na2CO3溶液
6月1日为“世界牛奶日”.某品牌高钙牛奶中富含蛋白质、糖类、无机盐等营养物质.下列叙述错误的是( )
A . 蛋白质、糖类都属于有机物
B . 人体缺钙易引起甲状腺肿大
C . 糖类由C,H,O三种元素组成
D . 误食重金属盐可喝鲜牛奶解毒
下列物质的分类,正确的一组是( )
A . Na2O、P2O5、H2CO3 都属于氧化物
B . NaOH、Fe(OH)3、Cu(OH)2 都属于碱
C . HNO3、H2CO3、KHCO3 都属于酸
D . CH4、CH3COOH、NH4HCO3 都属于有机物
某同学在实验操作考试中配制50g质量分数为2%的氯化钠溶液.
-
(1) 氯化钠的构成微粒是(用化学符号表示).
-
(2) 该同学量取水时俯视读数,会导致所配溶液溶质质量分数2%(选填“<”“>”或“=”).
-
(3) 若将15g该溶液稀释为1.5%的溶液,需要加入水的质量为g.
下列有关碳和碳的氧化物的说法,错误的是( )
A . 《清明河上图》至今图案清晰可见,是因为在常温下碳单质的化学性质稳定
B . 碳在空气充分燃烧时生成CO2 , 不充分燃烧时生成CO
C . CO和CO2组成元素相同,所以它们的化学性质也相同
D . CO可用于冶炼金属、做气体燃料; CO2可用于人工降雨、灭火
如图是初中化学实验室中制取气体的常用装置,回答下列问题。

-
(1) 写出如图所示装置中标有序号的仪器名称:②。
-
(2) 实验室用氯酸钾与二氧化锰混合制取氧气,该反应的化学方程式为。
-
(3) 若用上图中的F装置收集一瓶氧气,实验前将该装置装满水正放,则气体应从(填“c”或“d”)端进入。
-
(4) 实验室常用锌和硫酸制取氢气,其中可选择装置(选填装置序号)来制备和收集氢气,该反应的化学方程式为。
我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:

-
(1) 纯碱的化学式是。
-
(2) 反应②的基本反应类型为。
-
(3) 在贝壳上滴加稀盐酸,主要化学反应方程式是。
几种常见物质的pH范围如表,其中碱性最强的是( )
物质 | 酸奶 | 鸡蛋清 | 牙育 | 肥皂水 |
pH范围(常温) | 4~5 | 7~8 | 8~9 | 10~11 |
A . 酸奶
B . 鸡蛋清
C . 牙育
D . 肥皂水
下列对于宏观现象的微观解释中,错误的是( )
A . 被动吸烟而造成身体的危害,是因为分子在不断地运动。
B . 水沸腾时能将锅盖顶起来,是因为分子受热膨胀变大。
C . 酒香不怕巷子深,是因为分子在不断地运动。
D . 氧气加压后变成液态,是因为分子间的间隔变小。
我们已经知道了空气的主要成分是氮气和氧气,如图为测定空气中氧气含量的实验装置图。

-
(1) 甲同学:点燃红磷立即伸入瓶中并塞上瓶塞。待红磷燃烧停止并冷却后,打开止水夹,观察到集气瓶中吸入水的体积约占集气瓶容积的。
-
(2) 乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水其原因是。
-
(3) 同学与甲、乙同学共同对实验进行了以下分析:
①得出关于空气组成的结论;
②集气瓶底部要先放入少量水的作用为:。
③实验中,进入的水少于
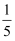 的原因。
的原因。④该实验进行如图改进,改进后的优点为:。

镁是一种银白色有金属光泽的金属,已经成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源.
以下是专门对镁的可燃性进行的一系列探究.
【实验用品】250mL集气瓶、玻璃棒、烧杯、导管、橡皮塞、止水夹、电阻丝、胶皮铜质导线、12V电源、一瓶二氧化碳气体、镁带、酚酞溶液、细沙等.
【实验操作】按图连接好装置,检查装置的气密性,用250mL集气瓶收集满二氧化碳气体,其内加入少量干净的细沙,接通12V电源.
【查阅资料】
①接通12V电源,可看到电阻丝红热;
②镁带在二氧化碳中能过剧烈燃烧,发出强光,生成白色固体,同时可清晰地看到镁带附近的集气瓶内壁附着一薄层黑色固体;
③MgO+H2O═Mg(OH)2 , Mg(OH)2⇌Mg2++2OH﹣ , OH﹣能使酚酞溶液变成红色.
【实验探究】
-
(1) 接通电源一会,观察到电阻丝红热,说明该实验中电能转化成,镁是一种较活泼的金属,在二氧化碳气体中也能燃烧,由此你对燃烧有什么新的认识:(写一点).
-
(2) 镁带在二氧化碳中燃烧,发生了(填基本反应类型)反应,气反应的方程式为,集气瓶底部铺一层干净的细沙的作用是.
-
(3) 【实验探究Ⅱ】镁带燃烧后冷却至室温,打开止水夹,观察到烧杯内,一段时间后集气瓶内的酚酞溶液变成色,其理由是与水慢慢反应生成了.

最近更新
- Life is like a game________you play five balls in the air
- 元素周期表里金属元素和非金属元素分界线附
- 如图所示,竖直平面内的轨道ABCD由水平轨道AB
- (2012年2月洛阳五校联考)如图所示p-V图中
- 3. --- Could I speak to Mary? --- Well, she’s on holida
- 有业内人士预估,由于污染严重和人们健康和
- 下列实验操作不正确的是( )A.点燃镁带
- 下列化学用语正确的是( ) A. 乙酸根离子
- 读表和有关材料,回答下列问题。 1950—2005年
- 在实验田中偶然出现了一株抗旱、抗盐的玉米
- 某溶液中大量存在五种离子:NO3-、SO42-、Al
- 下列不属于康熙帝作为的是( ) A.封达赖�
- 比较动植物细胞有丝分裂过程,可发现的不同
- 小黄家的电能表如图7所示,为了测量家里电
- 我国去年全年进出口总额2.2万亿美元,全年
- 两个亲本的基因型分别为AAbb和aaBB,这两对基
- 2009年8月15日起,公安部将在全国范围内严厉
- (1)下列关于分子运动和热现象的说法正确的是
- 下列言论反映了义和团运动具有反帝爱国性质
- 分析“我国某省级行政区的资料”(下表),根



