高中 化学
-
(1) 为了比较Fe、Co、Cu三种金属的活动性。某实验小组设计如图实验装置。

①甲装置中Co电极附近产生气泡,Co电极的电极反应式为。
②丙装置中X电极附近溶液先变红,X电极名称为,反应一段时间后,可制得NaClO消毒液,丙装置中的总反应方程式为。
③乙装置中交换膜类型为(填“阳”或“阴”)离子交换膜,三种金属的活动性由强到弱的顺序是。
-
(2) 为了测定市售白醋的总酸量(g/100mL),某实验小组设计如图实验流程。

①量取白醋样品10.00mL用到的量取仪器是,“配制100mL待测白醋溶液”用到的仪器有烧杯、玻璃棒和。
②“酸碱中和滴定”用0.1000mol•L-1NaOH标准溶液进行滴定。盛装待测白醋液的锥形瓶中应加入2~3滴溶液作指示剂,盛装NaOH溶液的滴定管初始液面位置如图所示,此时的读数为mL。

“酸碱中和滴定”实验记录如下
滴定次数
1
2
3
4
V(待测白醋)/mL
20.00
20.00
20.00
20.00
V(NaOH)(消耗)/mL
15.95
15.00
15.05
14.95
该市售白醋总酸量g/100mL(结果保留四位有效数字)。
③“酸碱中和滴定”过程中,下列操作会使实验结果偏大的是。
A.未用标准NaOH溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体减出
 ●、●OH表示自由基),定义比表面积为单位质量的物质所具有的表面积。设阿伏加德罗常数的值为NA。下列叙述错误的是( )
●、●OH表示自由基),定义比表面积为单位质量的物质所具有的表面积。设阿伏加德罗常数的值为NA。下列叙述错误的是( ) 
 小于1.5NA个
C . 碱性条件下硫酸根自由基发生反应的方程式为SO
小于1.5NA个
C . 碱性条件下硫酸根自由基发生反应的方程式为SO  ●+OH-=SO
●+OH-=SO 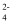 +●OH
D . pH越小,越有利于去除废水中的正五价砷
+●OH
D . pH越小,越有利于去除废水中的正五价砷
-
(1) 提取碘水中的碘;
-
(2) 除去食盐溶液中的水;
-
(3) 淡化海水
-
(4) KCl中含有KClO3.
 2Fe+3CO2
C . AgNO3+NaCl=AgCl↓+NaNO3
D . 2KMnO4
2Fe+3CO2
C . AgNO3+NaCl=AgCl↓+NaNO3
D . 2KMnO4  K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
 有3种同分异构体
D . 油脂和蛋白质都属于高分子化合物
有3种同分异构体
D . 油脂和蛋白质都属于高分子化合物
H2(g)+Cl2(g)=2HCl(g)△H=﹣184kJ/mol

请回答:
-
(1) H2与O2反应生成气态水的热化学方程式是。
-
(2) 断开1mol H﹣O 键所需能量约为kJ。
①2-丁醇 ②2-甲基-2-丙醇 ③1-丁醇 ④2-甲基-2-丁醇
-
(1) 该烃分子的摩尔质量.
-
(2) 确定该烃的分子式.
-
(3) 已知该烃的一氯代物只有一种,写出该烃的结构简式.
-
(1) 该实验中,用到的能确定体积的两种玻璃仪器是、.
-
(2) 操作过程中多次用到玻璃棒,其在实验中的作用有.
-
(3) 不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响(填“偏大”“偏小”或“不变”):
①在溶解过程中有少量液体溅出烧杯外.
②定容时仰视仪器上的刻度线.
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线.

下列说法正确的是( )

有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Mg2+、Ba2+、Cl-、CO32 -、SO42 -。现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+一定存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是()
| A. | 参加反应的CO2的体积为0.224a L | |
| B. | 用上述数据不能确定NaOH溶液的物质的量浓度 | |
| C. | 若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3 | |
| D. | b可能等于a、小于a或大于a |
如图是一密闭容器。已知A端盛有2.3 g金属钠,B端盛有x g HgO,当同时加热容器两侧的试管时,钠着火燃烧,冷却后测得容器中的空气成分并未发生变化,求x值。

- 如图,,过上到点的距离分别为的点作的垂线
- 在下列甲骨文字(图片)中描述分封制度的是
- 如图2所示是一种自动测定油箱内油面高度的
- 已知f(x)是定义域为(0,+∞)的单调函数
- 针对现在越来越多的人依靠键盘书写,汉字书
- 地图的指向标箭头指示 A.北方
- 第二节:读写任务(共1小题,满分25分) 阅
- Please give me _______ about the train to Hong Kong.
- It rained for two weeks, completely ________ our holiday.
- You'd better _______ your score and see if you have passe
- 三级行政区划指的是( ) A 省、州、县
- 下列各组数据不能反映可逆反应2AB+3C处于平衡
- )集合{-1,0,1}共有________个子集.
- 用“<”“=”或“>”号填空: -(+5) _
- 近代西方资本主义国家确立了不尽相同的政体
- Education and Training Make sure your skills are up-to-date
- 如图,△ABC≌△BAD,如果AB=7cm,BD=6cm,AD=4cm,
- 我国学者普遍认为,精耕细作是我国古代农业
- 某化学课堂围绕“酸碱中和反应”,将学生分
- 工业酒精中含有甲醇,甲醇有剧毒,不能食用



