高中 化学
-
(1) A的分子式是.
-
(2) 若A能与NaHCO3溶液反应放出CO2气体,其结构可能有种.
-
(3) 若A与NaOH溶液在加热时才能较快反应,且1molA消耗1mol NaOH,则A的所有可能的结构简式是.
-
(4) 若A与NaOH溶液在加热时才能较快反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有种,其中不能发生银镜反应的物质的结构简式是:.
|
A |
①能使溴的四氯化碳溶液褪色;②比例模型 |
|
B |
①由C、H两种元素组成;②比例模型为 |
|
C |
①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成酯 |
|
D |
①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
-
(1) D的官能团的名称是;
-
(2) 在铁的作用下,B与液溴反应的化学方程式为;
-
(3) C能与D反应生成酯,其化学反应方程式为,该反应的反应类型是。


-
(1) 物质Z在0~10min 的平均反应速率。
-
(2) 物质X和Y在反应中的转化率之比为。
-
(3) 写出该反应的化学方程式:。(物质用X、Y、Z表达)。
-
(4) 若已知该反应体系达到平衡状态时,共放出热量76.8kJ,则该反应的△H=。

下列有关EIDD2801的说法正确的是( )
 量取100.00mL溶液
C .
量取100.00mL溶液
C .  将萃取液中的苯与碘进行分离
D .
将萃取液中的苯与碘进行分离
D .  灼烧熔融碳酸钠固体
灼烧熔融碳酸钠固体
(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
| A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=______。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____________ ____,
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3mol FeS2参加反应,转移电子的物质的量为_______.
6SO2+Fe3O4,若有3mol FeS2参加反应,转移电子的物质的量为_______.
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________.
(3)将一定量的Fe2O3溶于160mL 5mol•L﹣1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为___.
用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH的含量时,可先在混合溶液中加入过量的氯化钡溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。试完成下列问题:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量?____________________________________________________________________。
(2)滴定终点时溶液颜色如何变化?______________________________________________。
(3)滴定时,若滴定管中滴定液一直下降到活塞处才到达终点,能否据此得出准确的滴定结果_______________(填“能”或“不能”)。
(4)能否改用甲基橙作指示剂(填“能”或“不能”) _______________,如果用甲基橙作指示剂,则测定结果如何?_______________(填“偏高”“偏低”或“正确”)。
实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
| 沸点/(℃) | 78.5 | 132 | 34.6 |
| 熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:______。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是______。
(4)在装置C中应加入____ (填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___ (填“上”或“下”)层。
(6)若产物中有少量副产物乙醚,可用____的方法除去。
起固定氮作用的化学反应是
A.雷雨时空气中的 NO转化为NO2B.N2与H2在一定条件下反应生成NH3
C.用NaOH吸收NO2和NOD.工厂用NH3催化氧化制NO
设NA为阿伏加德罗常数的值,下列说法正确的是
A.在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
B.110 g Na2S2中含有的离子数为3NA
C.0.1 mol·L-1 Na2CO3溶液1 L所含碳酸根数目为0.1NA
D.1 mol Cl2与足量的水反应时断裂的Cl-Cl键为NA个
(1)已知Na2CO3·10H2O(s) === Na2CO3(s)+10H2O(g);ΔH3=+532.36 kJ/mol
Na2CO3·10H2O(s) === Na2CO3·H2O(s)+9H2O(g);ΔH4=+473.63 kJ/mol
写出Na2CO3·H2O脱水反应的热化学方程式:_______________________________。
(2)合成氨工业的核心反应是:N2(g)+3H2(g) ![]() 2NH3(g) ΔH="Q" kJ·mol-1,其能量变化如图所示,回答下列问题:
2NH3(g) ΔH="Q" kJ·mol-1,其能量变化如图所示,回答下列问题:
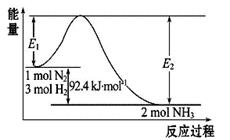
①在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2, 充分反应后,放出的热量____________46.2 kJ(填“<”、“>”或“=”)。
②关于该反应的下列说法中,正确的是_____________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
③将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率__________,若升高温度,K值变化____________(填“增大”、“减小”或“不变”)。
在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是
2C(气)+2D(固)达到平衡的标志的是
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④恒容下,混合气体的密度不再变化
⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A. ②⑧ B. ②⑤⑧ C. ①③④⑦ D. ②⑤⑥⑧
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是: ( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
- Whoever caught ________the rule will be punished.
- (9分)(2010·苏南模拟)在“探究力的平行四边形定则”的实验中,需要将橡皮条的一端固定在水平木板上,另一端系上两根细
- 对性腺组织细胞进行荧光标记,等位基因A、a都被标记为黄色,等位基因B、b都被标记为绿色,在荧光显微镜下观察处于四分体时期
- 已知一次函数y=kx+b﹣x的图象与x轴的正半轴相交,且函数值y随自变量x的增大而增大,则k,b的取值情况为() A.k
- ---- Jenny, you left your MP3 on the table when you went out
- 阅读下面一则新闻,为其拟写一个标题。(不超过20字)(4分) 包括关联储和欧洲央行在内的五个中央银行13号宣布,将联手推
- 阅读下列三个材料,完成以下题。 〔材料1〕小新背双腿瘫痪的同学小牧到1公里外的学校上学,从小学五年级到现在高中一年级,一
- 下列关于氨气的说法正确的是 A.氨气可以用碱石灰干燥也可用无水CaCl2干燥 B.氨水能导电,所
- 如图8所示,由不同物质制成的甲、乙两种实心球的体积相等,此时天平平衡。则制成甲、乙两种球的物质密度之比为:( )
- 读美国地区图,完成下列要求。(9%)(1)将图中字母代表的地理事物名称,填写在下面的横线内。 A
- This year’s fall in profits was not unexpected,it is very di
- 在LC振荡电路中,当电容器充电完毕尚未开始放电时,下列说法正确的是A.电容器中的电场最强
- (11·西宁)一节电池如图2所示,则它的三视图是
- 图13为我国主要汽车工业生产基地分布图,读图回答23~24题。图13 23. 影响我国汽车工业分布格局的主要因素
- 东莞本地人口约150万,外来人口约200万,其中港、澳、台同胞70万。世界著名十大电脑公司之一的某公司总裁指出,若东莞通
- 匀强磁场分布在半径为R的圆内,磁感应强度为B,CD是圆的直径.质量为m、电量为q的带正电粒子,由静止开始经加速电场加速后
- 在实验室的下列做法中正确的是 ( ) A. 为了节约药品,用剩的药品应放回原试剂瓶 B.为
- 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则
- —Morning,madam! What can I do ________ you? —I’d like a dr
- (14分)我国于2007年10月24日18时05分在西昌卫星发射中心成功发射一颗绕月运行的的探月卫星“嫦娥一号”已知月球
 ;③能与水在一定条件下反应生成C
;③能与水在一定条件下反应生成C




