高中 化学
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将新制氯水放在光下一段时间 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
| | | | |
A组 | B组 |
Ⅰ.H2O分子间存在氢键,H2S则无 | ①H2O比H2S稳定 |
Ⅱ.晶格能NaI比NaCl小 | ②NaCl比NaI熔点低 |
Ⅲ.晶体类型不同 | ③N2分子比磷的单质稳定 |
Ⅳ.元素第一电离能大小与原子外围电子排布有关,不一定像电负性随原子序数递增而增大 | ④同周期元素第一电离能大的,电负性不一定大 |
B组中命题正确,且能用A组命题加以正确解释的是( )
|
化学式 |
条件 |
1mol气体体积/L |
|
H2 |
0℃,101kPa |
22.4 |
|
O2 |
0℃,101kPa |
22.4 |
|
CO |
0℃,101kPa |
22.4 |
|
H2 |
0℃,202kPa |
11.2 |
|
CO2 |
0℃,202kPa |
11.2 |
|
N2 |
273℃,202kPa |
22.4 |
|
NH3 |
273℃,202kPa |
22.4 |
-
(1) 从表分析得出的结论:
①1mol任何气体,在标准状况下的体积都约为。
②1mol不同的气体,在不同的条件下,体积(填“一定”、“一定不”或“不一定”)相等。
-
(2) 理论依据:相同条件下,1mol任何气体的体积几乎相等,原因是:①,②。
-
(3) 应用:在标准状况下,4gO2的体积为。
-
(4) 等温、等压下,等体积的O2和O3所含分子个数比,质量比为。
-
(5) 已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为。
-
(6) 在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)分别用p(Ne)、p(H2)、p(O2)表示,由大到小的顺序是__。
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )


 和Ca2+ , 需要加入适当过量的除杂试剂,添加顺序为为BaCl2、Na2CO3
C . 吸收反应NaOH+H2O2+ClO2
和Ca2+ , 需要加入适当过量的除杂试剂,添加顺序为为BaCl2、Na2CO3
C . 吸收反应NaOH+H2O2+ClO2 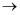 NaClO2+O2+H2O中,氧化产物是O2 , 氧化剂与还原剂的物质的量之比为1:2
D . 270gClO2与过量的NaOH、H2O2完全反应,计算生成的NaClO2的物质的量为4mol
NaClO2+O2+H2O中,氧化产物是O2 , 氧化剂与还原剂的物质的量之比为1:2
D . 270gClO2与过量的NaOH、H2O2完全反应,计算生成的NaClO2的物质的量为4mol

-
(1) a线分别代表溶液中的变化情况;
-
(2) c线分别代表溶液中的变化情况;
-
(3) 原溶液中Br-与Fe2+的物质的量之比为;

-
(1) 步骤①中加快反应速率的措施有(填一种)。
-
(2) 溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有。
-
(3) 鼓入空气并充分搅拌的目的是。
-
(4) 工业上制取Al的反应方程式为。
-
(5) 试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)。
将一块钠投入到盛有煤油和水的烧杯中,观察到的现象可能是( )
A.钠在水层中反应并四处游动
B.钠停留在煤油层中不发生反应
C.钠在煤油中的液面上反应并四处游动
D.钠在煤油与水的界面处反应并可能上下跳动
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)甲同学设计实验的依据是
__________________________________________________________________;
写出选用物质的化学式:A____________,B_____________,C____________;
其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(2)乙同学的实验原理是_____________________________________________;
写出B处的离子方程式: ___________________________________________。
下列关于热化学反应的描述中正确的是
A . HCl 和 NaOH 反应的中和热 ΔH=-57.3 kJ/mol ,则 H 2 SO 4 和 Ca(OH) 2 反应的中和热 Δ H =2×(—57.3) kJ/mol
B . CO(g) 的燃烧热是 283.0 kJ/mol ,则 2CO 2 (g)=2CO(g) + O 2 (g) 反应的 Δ H =+2×283.0 kJ/mol
C . 需要加热才能发生的反应一定是吸热反应
D . 1mol NO(g) 中的化学键形成时需要吸收 632 kJ 的能量
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 (1)写出该反应的平衡常数表达式:K=__________。已知:
(1)写出该反应的平衡常数表达式:K=__________。已知:
K300℃>K350℃,则该反应是____________热反应。
(2)图中表示NO2变化的曲线是__________。用O2表示从
0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是__________。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动
的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是
 | |||||||
 | |||||||
 | |||||||
 | |||||||
A B C D
在2L密闭容器中发生下列反应:
![]()
![]()
![]()
若最初加入的X、Y、Z都是2mol,反应中X的平均反应速率为0.12 mol/L・s,若要产物Z为2.6mol,反应需要的时间为 。
下列对实验操作的叙述错误的是( )
A、用胶头滴管加液时,不能伸入试管中
B、蒸馏盛在烧瓶中含水的酒精,需在瓶内放一些碎瓷片
C、温度计插入液体中测量温度的同时,又用它搅拌液体
D、用容积为100 mL的量筒量取80 mL无水乙醇,使液面最低点至刻度80 mL处
以苯酚为原料的合成路线如下所示,请按要求作答:

(1)写出以下物质的结构简式: B_______________, F________________
(2)写出反应①④的化学方程式: ①________________, ④___________
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为:___________________
下列有关化学用语表示正确的是
![]()
B.铝离子的结构示意图:![]()
C.质子数为35、中子数为45的溴原子:![]()
D. K2CO3水解的离子方程式:CO32-+2H2O⇌H2CO3+2OH-
- 设NA表示阿伏加德罗常数,下列说法不正确的是 A.任何气体单质在标况下体积为22.4L时,则含有2NA个原子 B.NA个
- 请补写出空缺的语句,与前两句构成排比,使语段意思连贯,风格统一。(4分) 作一次心灵旅行,就以那一本本零落的古卷残页为车
- 阅读下面这首唐诗,然后回答问题。(10分) 暑 旱 苦 热 王 令 清风无力屠得热,落日着翅飞上山。
- Food prices increased ________ 10% in less than a year.A. fo
- 下列各组物质相互混合后,不会发生离子反应的是()A.Na2SO4溶液和MgCl2溶液B.Na2CO3溶液和稀硫酸C
- 用苏丹Ⅲ染液对脂肪组织进行染色时,可用来冲洗浮色的药品是 ( ) A.HCl
- 国庆期间,某商家为了促销商品,在店堂门前,以国旗图案为背景,在上面发布广告,被工商部门查处。某商家的做法 A.损害了国家
- 在鸟卵的下列结构中,将来可以发育成雏鸟的是 A.胚盘 B.卵黄 C.卵白
- 根据句子的意思,看拼音写汉字。 (1)大约只有二十米,但在我眼中却是gāo bù kě pān
- — I’d like to invite you to our party this weekend. — Thank
- 水库中学星星文学社请作家杨笑天来做报告。下面是张田甜社长开场自中的一个片段,其中有四处不得体,请你找出来并进行修改。(4
- -Are there any English Story books for us students in the li
- 北京奥运会开幕的夜晚,全球几十亿电视观众聆听三千儒生吟诵中国先哲孔子的名句——“四海之内,皆兄弟也”,“有朋自远方来,不
- 一静止的质量为M的原子核发生一次α衰变。已知衰变后的α粒子的质量为m、电荷量为q、速度为v,并假设衰变过程中释放的核能全
- 电子产品制作车间里常常使用电烙铁焊接电阻器和电容器等零件,技术工人常将电烙铁和一个白炽灯串联使用,电灯还和一只开关并联,
- 目前,我国省级行政单位共有 A.23个 B.28个 C.31个
- 炒菜的铁锅坏了,不能用焊锡补,烧水的铁壶坏了能用焊锡补,这是因为( )
- 读材料,回答下列问题 材料一:世界部分区域图 材料二:全世界20个缺水国家,中东占11个,世界
- Yesterday I wasjust to go out _____ someone telephoned me. A
- 下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是 () A.电解CuSO4溶







