高中 化学
 B . 乙烯的球棍模型:
B . 乙烯的球棍模型:  D . 溴乙烷的官能团:-Br
D . 溴乙烷的官能团:-Br


 D .
D .  B . 比较两种物质的热稳定性
B . 比较两种物质的热稳定性 C . 实验室制取NH3
C . 实验室制取NH3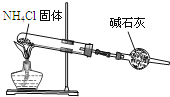 D . 分离沸点不同且互溶的液体混合物
D . 分离沸点不同且互溶的液体混合物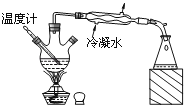
-
(1) ①写出MgO的名称;
②写出乙炔的结构式。
-
(2) 写出NaHCO3受热分解的化学方程式。
-
(3) 写出Cl2与NaOH溶液反应的离子方程式 。
-
(4) 海带中提取碘的过程中,将I-氧化生成I2时,若加入过量的氯水,则Cl2将I2氧化生成HIO3 , 同时还有一种强酸生成,写出该反应的化学方程式。
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、﹣2 | ﹣2 |
 和
和  两种溶液
D . 取用金属钠时,多余的钠应该放回原试剂瓶中
两种溶液
D . 取用金属钠时,多余的钠应该放回原试剂瓶中
-
(1) 基态氮原子的价电子排布式为。
-
(2) 14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为,以“肩并肩”方式形成的共价键数目为。
-
(3) C、N、O三种元素按第一电离能从大到小的排列顺序为。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1 , 其第二电离能增幅较大的原因是。
-
(4) 某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、、[Cr(NH3)4Cl2]Cl·2NH3。
-
(5) NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是。在VSEPR模型中NH4+的几何构型名称为。

-
(6) 已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA , 则NH4N3的密度为g·cm-3。

某同学欲用托盘天平称量21.5g氯化钠(5g以下用游码),他把氯化钠放在右盘,砝码放在左盘,当天平两边平衡时,他所称取的氯化钠的质量实际是( )
A.16.5g B.18.5g C.20.5g D.23.5g
实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1 mol CuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2+ + I-→ CuI+ I3-
由铜、锌和稀盐酸组成的原电池中,铜是 极,发生 反应,电极反应式是 ;锌是 极,发生 反应,电极反应式是 。
常温下,用 0.10 mol·L-1 NaOH 溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示:
 | |||
 |
图1 图2
则滴定HC1溶液的曲线是 _▲ (填“图1”或“图2”),说明判断依据 ▲ 。a与b的关系是:a _▲ b(填“>”、“<”或“=”);E点对应离子浓度由大到小的顺序为 _▲ ;
利用下列实验装置能达到相应实验目的的是
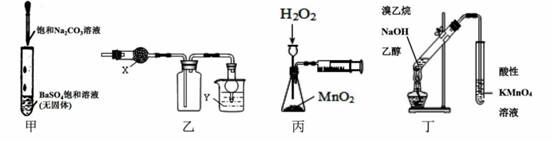
A.甲可用于研究沉淀的转化,可比较出Ksp(BaSO4)>Ksp (BaCO3)
B.乙中X为无水CaCI2,Y为NaOH溶液时,该装置可用于SO2的收集
C.丙装置可定量测定H2O2的分解速率
D.丁可用于证明实验中生成了乙烯
- 法国大革命期间,被囚禁狱中的国王路易十六曾感叹:“原来是伏尔泰和卢梭毁了法国!”这说明启蒙思想 A.点燃了革命火种
- Merry Christmas The winter holiday season is the most festiv
- 西欧封建制度的核心是:( )A.封建等级制度 B.封土制度 C.封君封臣制度 D.骑士
- 阅读下面一首诗,然后回答问题。 东岗晚步 李弥逊 饭饱东岗晚杖藜,石梁横渡绿秧畦。 深行径险从牛后,小立台高出鸟栖。 问
- We got into the car but found it difficult to ________ becau
- 长为20cm的轻绳BC两端固定在天花板上,在中点A系上一重60 N 的重物,如图所示.(1)当BC的距离为10 cm时,
- 已知服从正态分布的随机变量,在区间,和内取值的概率分别为,和.某大型国有企业为名员工定制工作服,设员工的身高(单位:)服
- 李约瑟在《中国科技史》中提道:“他们固然没有把个人与社会分开,也没有把社会与整个自然界分开。可是他们向来主张,研究人类的
- ---_____ you always question everything I say? ---Sorry if
- 阅读下面的文段,完成(1)一(3)题。(5分) 朔( )方的雪花在纷飞之后,却永远如粉,如沙,他们决不粘连,撒在屋
- 下面四个实验操作,正确的是 A.测量物体质量时调节平衡螺母B.探究水沸腾时温度变化的特点C.拿起量筒,测量水的体积D.手
- Sea Life Melbourne Aquarium (水族馆) The all-new Sea Life Melbo
- 一次函数y=-2x+m的图象经过点P(-2,3),且与x轴、y轴分别交于点A,B,则△AOB的面积是 ( )
- 十七大报告指出:“提高自主创新能力,建设创新型国家。这是国家发展战略的核心,是提高综合国力的关键”。下面事例不符合这一精
- 黄曲霉素(Cl7H12O6)是污染粮食(大米、花生等)的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,危害身体健康
- 17.阅读下面的文字,根据要求作文。 爱因斯坦认为,人在满足物质生活之外,应该用更多的时间去从事艺术之类的精神活动。读诗
- 在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应: 2NO2(g) N2O4(g);
- 若不等式1-loga<0有解,则实数a的范围是 .
- 下列实验现象叙述错误的一项是( ) A、铁在氧气中燃烧火星四射 B、硫在氧气中燃烧发出淡蓝色火焰 C、木
- 简述《红楼梦》中王熙凤逼死尤二姐的经过。(100字左右)



