高中 化学
 CH2=CH2↑+NaBr+H2O
C . 丙烯聚合:nCH2=CHCHCH3
CH2=CH2↑+NaBr+H2O
C . 丙烯聚合:nCH2=CHCHCH3  +CO2+H2O→
+CO2+H2O→  、
、  、
、  、
、  B . 与铝反应产生
B . 与铝反应产生  的溶液:
的溶液:  、
、  、
、  、
、  C . 使甲基橙呈红色的溶液:
C . 使甲基橙呈红色的溶液:  、
、  、
、  、
、  +
D . 透明澄清溶液:
+
D . 透明澄清溶液:  、
、 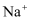 、
、  、
、 
 时,往一密闭容器中通入
时,往一密闭容器中通入  和
和  ,反应达到平衡时,容器内压强是反应前的四分之三.此时
,反应达到平衡时,容器内压强是反应前的四分之三.此时  的转化率为( )
的转化率为( )
 B .
B .  C .
C .  D .
D . 
 B . H+、Cl-、Na+、CO
B . H+、Cl-、Na+、CO C . Mg2+、Ag+、NO
C . Mg2+、Ag+、NO 、Cl-
D . Na+、CO
、Cl-
D . Na+、CO 、Cl-、K+
、Cl-、K+
 、
、  、
、  ②H2O,D2O ③石墨、金刚石 ④H,D,T 四组微粒或物质,回答下列问题:
②H2O,D2O ③石墨、金刚石 ④H,D,T 四组微粒或物质,回答下列问题:
-
(1) 互为同位素的是.(填序号)
-
(2) 互为同素异形体的是.(填序号)
-
(3) 由①和④中微粒能结合成含三个原子的化合物,其中分子量最大的是(填化学式).

-
(1) 铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作(填 “阳”或“阴”)极,铜离子向极移动,阴极的电极反应式为。
-
(2) 下图中,为了减缓海水对铁闸门A的腐蚀,材料B可以选择(填字母序号)。

a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:。
-
(3) 将FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为。
已知![]() (b)、
(b)、![]() (d)、
(d)、![]() (p)的分子式均为C6H6,下列说法正确的是
(p)的分子式均为C6H6,下列说法正确的是
A.b的同分异构体只有d和p两种
B.b、d、p的二氯代物均只有三种
C.b、d、p中只有b的所有原子处于同一平面
D.b、d、p均可与酸性高锰酸钾溶液反应
下列离子方程式正确的是
A . Na 2 CO 3 溶液中通入过量氯气: +Cl 2 = CO 2 +Cl - +ClO -
B . Fe(OH) 3 溶于过量 HI 溶液: Fe(OH) 3 +3H + = Fe 3+ + 3H 2 O
C . 将 CO 2 通入足量 BaCl 2 溶液: CO 2 +H 2 O+Ba 2+ =BaCO 3 ↓ +2H +
D . 酸性碘化钾淀粉溶液久置空气中变蓝: 4I - +O 2 +4H + =2I 2 +2H 2 O
1)25℃时,浓度为0.1 mo1·L-1的6种溶液:①HCl,②CH3COOH ③Ba(OH)2 ④Na2CO3 ⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_______________(填写编号)
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=_______ mo1·L-1 (保留到小数点后一位)。
(3)25℃时,pH=3 的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________(填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:________________________________。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH= 7,则溶液中c (CH3COO-)+c(CH3COOH)= _____________,m与n的大小关系是m_____n (填“>”“=”或“<”)。
(5)当300mL 1 mo1·L-1的NaOH 溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为_________________________________________。
离子方程式 
① HCl ② H 2 SO 4 ③ HNO 3 ④ NaHSO 4 ⑤ CH 3 COOH
A . ①③ B . ①④⑤ C . ②④⑤ D . ①⑤
下表中物质的分类组合,完全正确的是
| 编号 | A | B | C | D |
| 强电解质 |
|
|
|
|
| 弱电解质 |
|
| HClO |
|
| 非电解质 |
| Al |
|
|
A. A B. B C. C D. D
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
- 人体呼出的气体,二氧化碳增多了,这二氧化碳产生于( )A.肺泡B.组织细胞C.血液D.组织液
- 利用图甲进行“测量未知电阻”的实验. 电压U/V 1.5 2.0 电流I/A 0.30 0.42 0.50 电阻Rx/Ω
- -What____will youget after winning the competition in the pr
- 如图所示为杂技“顶杆”表演,一人站在地上,肩上扛一质量为M的竖直竹竿,当竿上一质量为m的人以加速度a加速下滑时,杆对地面
- 为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2
- 某蛋白质的相对分子质量为11935,在合成这个蛋白质分子过程中脱水量为1908,假设氨基酸的平均相对分子质量为127,则
- 请以笔画线代替导线将图中的螺口灯泡和灯泡开关正确接入家庭电路中。
- 有些动物的身体内有由脊椎骨组成的脊柱,有些动物则没有。在下列生物中,全属于脊椎动物的一组是 A.家鸽、龟、鲫鱼
- 李某是一国有企业工程师,去年工资收入36000元,奖金8000元,个人专利转让收入5000元;其妻开一家个体杂货店,年收
- 下列首都中被誉为“花园城市”的是: ( ) A、曼谷 B、河内 C
- (6分)在“探究加速度与力、质量的关系”的实验中,采用如图所示的实验装置,小车及车中砝码的质量用M表示,盘及盘中砝码的质
- 人类目前所消耗的能量主要来自化石燃料. (1)石油加热炼制得到的产品中,常用作汽车燃料的是(一种即可). 煤燃烧时排放出
- 符合右图中阴影部分的物质是 ( )A.Na2CO3 B.Cu2(OH)2CO3 C.NaCl D.Na
- 数列所有项的和为,第二项及以后各项的和为,第三项及以后各项的和为 ,第项及以后各项的和为,若 , ,,…,,则等于
- 培养某哺乳动物胚胎干细胞,测量其细胞周期为G1期(DNA合成准备期)10h、S期(DNA复制期)8h、G2期(纺锤丝形成
- 阅读能力考察 王曰:“善。”乃下令:“群臣吏民能面刺寡人之过者,受上赏;上书谏寡人者,受中赏;能谤讥于市朝,闻寡人之耳者
- 我国广东大亚湾核电站是我国首座大型商用核电站,年发电量近150亿千瓦时。核电站是利用核裂变产生的核能来发电的。下列四个核
- 用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是() 选项 操作及现象 溶液 A 通入CO2,溶液变浑
- 6.数学史专家钱宝琮深入研究《九章算术》后,认为《九章算术》的编纂者对待数学的态度是:“掌握数学知识的人应该满足于能够解
- 下列句子中与例句的句式相同的一项是( ) 例句:何为其然也 A、此非曹孟德之困于周郎者乎



