高中 化学

-
(1) 该浓硫酸的物质的量浓度为 。
-
(2) 某学生欲用该浓硫酸和蒸馏水配制500 mL 1.0 mol· L-1的稀硫酸,进行了如下操作:
A.用少量蒸馏水洗涤烧杯内璧及玻璃棒2~3次,将每次洗涤液均转移到500 mL容量瓶中,振荡。
B.用量筒量取
 mL(保留 1位小数)该浓硫酸,注入盛有一定量蒸馏水的烧杯中,并用玻璃棒慢慢搅拌,使其混合均匀。
mL(保留 1位小数)该浓硫酸,注入盛有一定量蒸馏水的烧杯中,并用玻璃棒慢慢搅拌,使其混合均匀。C.将已冷却的硫酸溶液沿玻璃棒注入容量瓶中。
D.将容量瓶盖紧,颠倒摇匀。
E.改用
 (填仪器名称)加水,使溶液凹液面恰好与刻度线相切。
(填仪器名称)加水,使溶液凹液面恰好与刻度线相切。F.继续往容量瓶内小心加入蒸馏水,直到液面接近刻度线1~2 cm处。
①请将上述操作步骤填写完整: B. , E. 。
②将上述步骤按正确顺序排列: 。 (用字母表示,每个字母只能用一次)
③在配制过程中,下列实验操作会导致所配稀硫酸物质的量浓度偏大的是 。
a.定容后经振荡、摇匀、静置,发现液面下降,再滴加蒸馏水至刻度线
b.定容时仰视刻度线
c.溶液注入容量瓶前没有冷却至室温
-
(3) 取上述配制的稀硫酸时,下列物理量中不随所取体积的多少而变化的是 ____。A . 溶液中H2SO4的物质的量 B . 溶液的浓度 C . 溶液中SO
 的数目
D . 溶液的密度
的数目
D . 溶液的密度
-
(1) 某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图,电子排布式。该元素形成的单质为晶体。
-
(2) 指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、。
-
(3) 在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号) 。
-
(4) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO3HClO4;H3PO4H3PO3。
-
(5) 根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为杂化,VSEPR构型为,分子的立体构型为。
②BF3中心原子的杂化方式为杂化,分子的立体构型为。
-
(6) H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于 。
 2SO3 , 在混合气体中充入一定量的18O2 , 足够长的时间后, 18O原子()
2SO3 , 在混合气体中充入一定量的18O2 , 足够长的时间后, 18O原子()
 )作为一种常用药,具有解热镇痛的效果。乙酰苯胺可通过苯胺(
)作为一种常用药,具有解热镇痛的效果。乙酰苯胺可通过苯胺(已知:I.苯胺在空气中易被氧化。
II.可能用到的有关性质如下:
名称 | 熔点/℃ | 沸点/℃ | 溶解度/g(20℃) | |
水 | 乙醇 | |||
苯胺 |
| 184 | 3.4 | 任意比混合 |
冰醋酸 | 16.6 | 118 | 任意比混合 | 任意比混合 |
乙酰苯胺 | 114.3 | 304 | 0.46 | 36.9 |
(温度高溶解度大) | ||||
制备乙酰苯胺的具体流程如下:

回答下列问题:
-
(1) 写出制备乙酰苯胺的化学方程式。
-
(2) ①加入的锌粒的作用是(写两条)。
②加入的冰醋酸要过量的目的。
-
(3) 步骤1所用装置如图所示。

①a处使用的仪器为(填“A”、“B”或“C”),该仪器的名称是。
②反应体系的温度控制在100℃~105℃,目的是。
③判断反应基本完全的现象是。
-
(4) 步骤3中洗涤乙酰苯胺粗产品最合适的试剂是(填标号)。A.冰水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
-
(5) 步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→→冷却结晶→过滤→洗涤→干燥。
 的溶液中:
的溶液中:  、
、  、
、  、
、 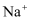 B . 由水电离的c(H+)=1×10-14mol/L的溶液中:
B . 由水电离的c(H+)=1×10-14mol/L的溶液中:  、
、  、
、  、
、  C .
C . 
 的溶液中:
的溶液中:  、
、  、
、  、
、  D .
D .  的溶液中:
的溶液中:  、
、  、
、  、
、 
A.过滤 B.聚沉 C.凝胶 D.布朗运动 E.电泳 F.丁达尔效应
-
(1) Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫;
-
(2) 光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫;
-
(3) Fe(OH)3胶体中加入硅酸胶体(胶体粒子带负电),胶体变得浑浊,这是发生了;
-
(4) 鉴别Fe(OH)3胶体和盐酸的方法是.
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
 、
、 B .
B .  、
、 C .
C .  、
、 D .
D .  、
、
有一瓶无色透明溶液,其中可能含有Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、I- 。取该溶液进行以下实验:
①用PH试纸测得该溶液显酸性;
②取部分溶液,加入数滴新制氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变至碱性,在整个滴加过程中无沉淀生成;
④取部分③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成;
(1)该溶液为无色透明溶液,可确定其中一定不含 ;(填离子符号,下同)
(2)由步骤①可知,溶液中一定不存在 ;
(3)由步骤②可知,溶液中含有 ;
(4)由步骤③可排除 、 的存在;
(5)由步骤④可知,溶液中含有 ,由此可排除 的存在;
(6)试验中不能够确定是否存在的阳离子可用 (填操作名称)进行检验。
如图所示,小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合的。
(1)图中属于烷烃的是________(填字母)。

(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成________和________;不仅可以形成________,还可以形成碳环。
(3)上图中互为同分异构体的是A与________;B与________;D与________(填字母)。
(4)1 L A的同系物的蒸气完全燃烧时,生成同温同压下4 L的水蒸气,该烷烃的分子式是________。
下列有关物质的用途错误的是
A.水玻璃可用作木材防火剂 B.二氧化硅是制造光导纤维的材料
C.可用氢氟酸刻蚀玻璃 D.石英是制造太阳能电池的常用材料
聚合氯化铝(化学式为[Al2(OH)nCl6-n•xH2O]m)晶体是一种高效无机水处理剂,下图是实验室模拟工业制备聚合氯化铝晶体的工艺流程,制备原料主要是铝加工行业的废渣铝灰,主要含Al2O3、Al,含有SiO2等杂质.

(1)试剂X(写名称)是____________,操作2包含过滤、_______和干燥。
(2)生产过程中操作1的操作步骤____________________________________。
(3)当m=1时,制备[Al2(OH)nCl6-n•xH2O]m的离子方程式:________________.生产中要严格控制溶液中pH,过小,则氯化铝水解不完全,且m值偏小,产品产量质量会降低.而pH过大,产量也会降低,其原因是_______________________________________.
(4)工业上采用电解装置制取活泼金属铝,若阳极产生的氧气全部与石墨电极反应生成CO和CO2气体,若生产中每生成8.1 gAl,阳极损失石墨3.0g,则理论上产生CO的物质的量是_________________________。
下表列出了周期表短周期中6种元素的有关数据:
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 原子半径(nm) | 0.075 | 0.110 | 0.152 | 0.071 | 0.186 | 0.099 |
| 最高价态 | +5 | +5 | +1 | 0 | +1 | +7 |
| 最低价态 | ﹣3 | ﹣3 | 0 | ﹣1 | 0 | ﹣1 |
根据上表信息填空:
(1)写出下列编号对应元素的元素符号:② ,③ .
(2)元素④在周期表中的位置是 .
(3)元素⑤形成的两种常见氧化物的化学式分别为 、 ,其中都含有的化学键是 .
(4)①的氢化物和⑥的氢化物反应的化学方程式为 .
四个体积相同的密闭容器中,在一定条件下,发生如下反应:N2+3H2![]() 2NH3,化学反应速率最小的是( )
2NH3,化学反应速率最小的是( )
| 容器 | 温度(℃) | N2(mol) | H2(mol) | 催化剂 |
| A | 500 | 1 | 3 | 有 |
| B | 500 | 0.5 | 1.5 | 有 |
| C | 450 | 1 | 3 | 无 |
| D | 450 | 0.5 | 1.5 | 无 |
请认真审题并作答:
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_______________________。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2,由此可以推知CN22-的空间构型为__________________。
(2)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。

(4)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ·mol-1、NaCl 786kJ·mol-1。导致两者晶格能差异的主要原因是________________。
- 消费者购买商品是为了 A.获得商品的价值 B.获得商品的使用价值 C.同时获得商品的价值和使用价值 D.获得商品的交换价
- 中国古代科技没有成功地发展成为近代自然科学,最根本的制约因素是 A.腐朽的君主专制制度
- 关于自由落体运动,以下说法正确的是( )A.质量大的物体自由下落是的加速度大B.从水平面飞行着的飞机上释放的物体将做
- 某玩具工厂出售一种玩具,其成本价为每件28元,如果直接由厂家门市部销售,每件产品售价为35元,同时每月还要支出其他费用2
- 如图所示,两水平放置的平行金属板A、B间为一匀强电场,A、B相距5cm,C、D为电场中的两点,且CD=4cm,CD连线和
- 若有意义,则x的取值范围是() A.x≥2 B.x≥﹣2 C.x>2
- 有关下图的叙述中,正确的是( )A.图中有两条捕食链 B.狐与鸟之间既捕食又竞争 C.细菌占有第二、三、四、五营养
- 抛物线y=4x2按向量a=(1,2)平移后,其顶点在一次函数y=x+的图象上,则b=__________.
- 台湾省容易遭受的自然灾害是: A.寒潮和台风 B.洪涝和沙尘暴 C.台风和地震 D.沙尘暴和泥石流
- “一粥一饭,当思来处不易;半丝半缕,恒念物力维艰”。这启示我们要 A.量人为出,适度消费 B.避免盲从,理
- (12分)A、B、C、D、E是短周期元素,周期表中A、B、C同周期,C与E同主族。A与C的最外层电子数之比为2∶3,B的
- 饮用水的净化过程一般要经过三个阶段:贮存、净化、输水.水库将雨水、江河和溪流里的水汇集贮存起来,净化时首先在水中加入沉淀
- 如图5-3-3所示,线圈平面与水平方向成θ角,磁感线竖直向下,设磁感应强度为B,线圈面积为S,则穿过线圈的磁通量Ф=__
- 读下面一段歌词,请摹仿画线的部分另写一句形式相同、内容相异的歌词。(3分) 带走一盘渔火,让它温暖我的双眼;留下一段真情
- 有机物种类繁多的原因的主要原因 ( ) A. 有机物分子结构十分复杂B. 自
- 如图,在中,AB=10,AC=8,BC=6,经过点C且与边AB相切的动圆与CA,CB分别相交于点P,Q,则线段PQ长度的
- 2008年11月8日的《深圳晚报》刊登了题为“变性人刘*回家结婚”的新闻,引起了不小的轰动。今年39岁的刘*虽是男儿身,
- People Who Moved China, hosted by CCTV, honours the people
- It would be very safe if you_________ thedoor_________ to t
- 若函数f(x)=kx﹣lnx在区间(1,+∞)单调递增,则k的取值范围是() A.(﹣∞,﹣2]B.(﹣∞,﹣1]C.[




