高中 化学
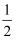 O2(g)═H2O(g)△H=﹣241.8 kJ/mol
D . 2C(s)+O2(g)═2CO(g)△H=﹣221 kJ/mol
O2(g)═H2O(g)△H=﹣241.8 kJ/mol
D . 2C(s)+O2(g)═2CO(g)△H=﹣221 kJ/mol
-
(1) 在①NaCl、②NaOH、③Na2O2、④N2、⑤H2S、⑥H2O2中,只含有离子键的是;只含有极性键的是;只含有非极性键的是;既含有离子键,又含有极性键的是;既含有离子键,又含有非极性键的是。
-
(2) 请用电子式表示NaCl的形成过程:。
-
(3) N2的结构式为:;H2O2的结构式为:。

-
(1) 气体发生装置中进行的反应化学方程式。
-
(2) Cl2的密度比空气,且(填“能”或“不能”)溶于水,难溶于饱和食盐水,因此可以用法或排除饱和食盐水法收集。
-
(3) 在装置中:浓硫酸的作用是。
-
(4) 该实验缺少尾气吸收装置,应该选用的试剂为。
求:
-
(1) 反应中消耗HCl的物质的量。
-
(2) 该混合物中铝、铁的物质的量。
 +H2SiO3
B . 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO
+H2SiO3
B . 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO  C . 硅与氢氟酸的反应:Si+4H++4F﹣═SiF4↑+2H2↑
D . 二氧化硅溶于烧碱溶液中:SiO2+2OH﹣═SiO
C . 硅与氢氟酸的反应:Si+4H++4F﹣═SiF4↑+2H2↑
D . 二氧化硅溶于烧碱溶液中:SiO2+2OH﹣═SiO  +H2O
+H2O
-
(1) 实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是、。
-
(2) 实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
-
(3) 他们记录的实验数据如表:
实验用品
溶液温度
中和热
t1
t2
ΔH
①
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.3 ℃
②
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
-
(4) 若用KOH代替NaOH,对测定结果
(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。
 2SO3 , 当达到平衡时通入18O2 , 再次平衡时,18O存在于( )
2SO3 , 当达到平衡时通入18O2 , 再次平衡时,18O存在于( )
金属 | 实验操作 | 实验现象 |
甲 | ①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 | 粉末溶解,有红棕色气体产生 有白色沉淀生成 |
乙 | ③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 | 粉末溶解,有气泡产生 有白色沉淀生成 _____________________ |
根据实验,回答下列问题:
-
(1) 甲与浓硝酸反应的化学方程式是。
-
(2) 实验操作⑤的实验现象是,乙溶解在NaOH溶液中反应的离子方程式是。
-
(3) 欲“比较甲和乙的金属活动性顺序”,实验的操作步骤是。
短周期元素X、Y、Z在周期表中的位置关系如图所示。

(1)X元素在周期表中的位置是________;
(2)Y、Z元素的气态氢化物中,最稳定的是__________(填化学式);
(3)与Y元素同主族且相邻的元素的单质与NaOH溶液反应的离子方程式是________。
“瘦肉精”:一种能减少脂肪增加瘦肉作用的药品,有很危险的副作用,轻则导致心律不整,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是 ( )

克伦特罗clenbuterol 莱克多巴胺 ractopamine
A.克伦特罗分子的分子式为C12H18ON2Cl2
B.克伦特罗能发生加成、氧化、消去等反应
C.克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D.莱克多巴胺与足量NaOH反应,生成物的化学式为C18H20NO3Na3
(1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸?
(2)某有机物的结构简式为HOOC—CH=CHOH。
①请你写出该有机物官能团的名称: 、 、 。
②验证该有机物中含有-COOH官能团常采用的方法是 ,产生的现象为 。
4月7日是“世界卫生日”。今年世界卫生日的主题是“停止排斥,敢于关怀”,强调关注人类心理健康问题。江苏等省从2004年5月起已推行以“铁强化酱油”为主的“补铁”工程。所谓铁强化酱油即在普通酱油中加入极易被人体吸收的添加剂――EDTAFeNa(乙二胺四乙酸铁钠)。试回答下列问题
①已知EDTAFeNa的化学式为C10H12FeN2NaO8,它是EDTA的(结构简式如下:
 )的盐,下列说法正确的有 。
)的盐,下列说法正确的有 。
A.EDTA属于四元有机酸 B.铁是人体中不可缺少的微量元素
C.EDTAFeNa中铁为+3价 D.人体血液中血红蛋白中铁为+2价
已知 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.元素C、D的最高价氧化物对应的水化物之间不能发生反应
C.元素D和E可形成共价化合物
D.化合物AE与CE含有相同类型的化学键
对相对分子质量为128的烃的下列说法,正确的组合是
①可能是芳香烃 ②可能是苯的同系物 ③分子中不可能都是单键 ④分子中可能都是单键
A.只有①② B.只有①③ C.只有②③ D.只有①④
- 如图,⊙O的半径为2,C1是函数y =x2的图象,C2是函数y=﹣x2的图象,则阴影部分的面积是 .
- .如图,图中x的值为( )A.50 B.60 C.70
- “快来扒一扒是谁在规划十三五?党中央国务院,还有各级部委办,工人农民企业家,专家教授你我他,中国的十三五,大伙儿来做主
- The sign reads “in ease of___ fire ,break the glass and push
- 关于能记录地球历史的岩石的叙述,不正确的是A.是岩浆岩 B.主要由外力作用形成 C.含有生物化石
- 在有氧呼吸过程中,进入细胞中的氧将 ①与氢结合生成水 ②与碳结合生成二氧化碳 ③在线粒体中被消耗 ④在线粒体和细
- 为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质
- 如图所示,将两滴等量的水分别滴在两块玻璃板上,其中被加热的水滴先消失。说明:
- 下列计算中,正确的是 (
- 下列中学常见实验的现象或表述正确的是() A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN
- .右图是原始居民使用的骨耜和装有木柄的骨耜复原图,它的功能是( ) A.制陶 B.耕地 C.造房 D.捕鱼
- 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。 42.2g K4[Fe(CN)6] •3H2
- 最能体现商鞅变法性质的措施是 A.改变了“刑不上大夫”的传统 B.重农抑商,奖励耕织 C.废初“世卿世禄”制度
- 子曰:“学而不思则罔, 。”(《论语·为政》)
- The first time I remember noticing the crossing guard wa
- 下列关于太阳活动对地球的影响,叙述正确的是( ) A.黑子每 11 年出现一次,与自然灾害的发生密切相关 B.耀斑爆
- It is the teacher____taught me when I was a child____I am go
- 用两种方法解方程:x2-6x+1=0.
- 惠帝二年,萧何卒,参闻之,告舍人:“趣治行,吾将入相。”居无何,使者果召参。参始微时,与萧何善,及为将相,有卻
- 20℃时,将10 mL 0.1mol/L Na2S2O3溶液和10 mL0.1 mol/L的H2SO4溶液混合,2 mi



