高中 化学

下列说法正确的是( )
 或
或  ,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是( )
,pY=-lg Y,题中涉及浓度的单位为mol•L-1。下列叙述错误的是( ) 
 与混合溶液pH的变化关系
B .
与混合溶液pH的变化关系
B .  =103.9
C . NaHR溶液中存在:c(Na+)<c(HR-)+2c(R2-)
D . 滴加稀硫酸的过程中,
=103.9
C . NaHR溶液中存在:c(Na+)<c(HR-)+2c(R2-)
D . 滴加稀硫酸的过程中,  保持不变
保持不变

-
(1) 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
-
(2) 如果电解过程中铜全部析出,此时电解能否继续进行,为什么?.

部分化合物的Ksp如下表所示:
| 物质 | PbCl2 | PbS | PbCrO4 |
| Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
-
(1) “焙烧”生成的气体可用于工业制备。
-
(2) 写出“高温还原”的主要化学方程式:。
-
(3) “粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为。阳极泥的主要成分为。
-
(4) 铅与稀盐酸反应产生少量气泡后反应终止,原因是。写出制备PbO2的离子方程式:。
-
(5) Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀?(列式计算说明,Ka1(H2S)=1.3×10-7 , Ka2(H2S)=7.1×10-15)。
-
(6) 将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是,反应的离子方程式为。
-
(1) 已知反应:①C(s)+
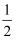 O2(g)=CO(g)△H1=﹣110.5kJ•mol﹣1
O2(g)=CO(g)△H1=﹣110.5kJ•mol﹣1②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ•mol﹣1
写出表示CO燃烧热的热化学方程式.
-
(2) 搭载神舟十一号航天飞船的长征二号F运载火箭的助推器、芯一级、芯二级应用的燃料全部是液态偏二甲肼和液态四氧化二氮.其中偏二甲肼(C2H8N2)为火箭燃料,四氧化二氮(N2O4)为氧化剂,当它们混合时,立即产生大量氮气、二氧化碳和水蒸气,并放出大量热. 若0.1mol 偏二甲肼与N2O4完全反应时,放出 526.65kJ的热量.写出该反应的热化学方程式:.
-
(1) 用过量铜片与0.2mol浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1mol,理由是;
而乙同学认为产生的SO2为0.1mol,理由是.
-
(2) 实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的.铜屑在此状态下被溶解的化学方程式为.
利用铜制备CuSO4的另一种方法可用化学方程式表示为.
以上两种方法(填“前”或“后”)者好,原因是.耗H2SO4少.


 Mg(OH)2
Mg(OH)2  MgCl2溶液
MgCl2溶液  Mg
B . Cu
Mg
B . Cu  CuSO4溶液
CuSO4溶液  CuSO4•5H2O
C . 饱和食盐水
CuSO4•5H2O
C . 饱和食盐水  NaHCO3
NaHCO3  Na2CO3
D . N2
Na2CO3
D . N2  NH3
NH3  NO→NO2
NO→NO2  HNO3
HNO3
|
族 周期 |
IA |
0 |
||||||
|
1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
2 |
② |
③ |
④ |
|||||
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
||||
|
4 |
⑨ |
⑩ |
-
(1) 写出①、③和⑧三种元素组成的某种可以消毒杀菌物质的电子式:。
-
(2) ⑨原子的价电子排布式。
-
(3) 写出工业冶炼⑥的单质的化学反应方程式。
-
(4) ②、⑤、⑥的原子半径由大到小的顺序为(用元素符号表示)。
-
(5) ①与②按原子数之比1:1构成平面正六边形结构的某化合物甲,其不能使酸性高锰酸钾溶液褪色。⑩的单质易溶于化合物甲,其原因是。写出化合物甲与⑩的单质反应的方程式。
在标准状况下,将O2和NO2按1;4体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( )
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
实验室用下列仪器组装一套蒸馏食盐水的装置,并进行蒸馏得到蒸馏水。

(1)写出下列仪器的名称:①_____;②____;③______。
(2)可用于分离或提纯物质的方法有
A.过滤 B.升华 C.加热分解 D.洗气法 E. 蒸馏 F.结晶 G.萃取 H.分液
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填字母)
① 分离乙醇与水的混合物,用 。
②从硝酸钾和氯化钾混合液中获取硝酸钾,用 。
 已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
数据:7.2×10﹣4、4.6×10﹣4、4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2===HCN+NaNO2,②NaCN+HF====HCN+NaF,③NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
A. HF的电离平衡常数为7.2×10﹣4
B. HNO2的电离平衡常数为4.9×10﹣10
C. 根据①③两个反应即可知三种酸的相对强弱
D. HNO2的电离平衡常数比HCN大,比HF小
下列化学用语的表述不正确的是
A.过氧化氢的结构式:H—O—O—H
B.氮原子的L层电子轨道表示式:
C.CO2的比例模型:![]()
D.Cl-的结构示意图:![]()
- 已知是双曲线的左、右焦 点,设双曲线的离心率为.若在双曲线的右支上存在点,满 足,且,则该双曲线的离心率等于 (A
- 由于在奶粉的生产过程中,人们人为地加入三聚氰氨,结果导致婴儿急性肾功能衰竭。这里被加了三聚氰氨的奶粉
- 下列实验能获得成功的是 A.用酸性高锰酸钾溶液鉴别正己烷和乙醇 B.用分液漏斗分离乙醛和水 C.用苯、溴水和铁粉混合制取
- 受季风气候影响,我国水资源的季节分配和地区分布很不均匀。图8为我国水资源空间分布示意图,读图回答22~24题。22.从图
- 下列有关ATP的相关叙述中,正确的是 ①人体成热的红细胞、蛙的红细胞、鸡的红细胞中均能含成ATP ②若细胞内Na+浓度偏
- 阅读图文材料,回答问题。 材料一 巴黎和会上美国总统威尔逊说:“我们参加世界战争,主要目的就是要维持条约的神圣.中日两
- 1998年,吉林省第四届村民委员会换届选举中,百分之八十以上的农村采取了“海选”方式提名初步候选人。这一做法( )
- 某单位有名成员,其中男性人,女性人,现需要从中选出名成员组成考察团外出参观学习,如果按性别分层,并在各层按比例随机抽样,
- 以下两题选做一题。要求:①内容具体,有真情实感;②除诗歌外,文体不限;③字数不少于600字;④凡涉及真实的人名、校名、地
- I haven’t seen Jack for days. I hear he has been very busy _
- 2005年是世界反法西斯战争胜利60周年,下列关于二战的影响,正确的是①战争教育了各国人民,争取和平和进步的思想日益深入
- Thousands of people were attracted to a2-meter-wide lane in
- 第二节:完形填空(共20小题,每小题1.5分,满分30分) 阅读下面短文,从短文后各题所给的四个选项(A、B、
- (一)下左图代表绿色植物的一个叶肉细胞及其相关生理过程示意图 (1)图中Ⅰ,Ⅱ两种结构的膜面积都很大,其中Ⅰ增加膜面积通
- 将下列文章按作者姓氏的音序进行排列。 《乡愁》 《春》 《曹刿论战》 《行路难》 《岳阳楼记》
- 下列各组词语中,加点字的读音全都正确的一组是 A.兑换(duì) 摈弃(bìn) 退避三舍(shè)
- 水平恒力F两次作用在同一物体上,使物体沿力的方向发生相同位移,第一次是在光滑水平面上,第二次是在粗糙水平面上,两次力F
- One day, Wilson was walking quietly along the road when
- 已知某种粒子的结构示意图为,该粒子属于______(填“原予”或“离子”)。若该原子的相对原子质量为32,则其原子的最外
- 根据我国三大自然区的相关知识,回答关于三大自然区概况的叙述,正确的是A.西北干旱半干旱地区所占面积最大B.东部季风区是我



