高中 化学
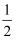 O2(g)△H=﹣485kJ•mol﹣1
B . H2O(g)═H2(g)+
O2(g)△H=﹣485kJ•mol﹣1
B . H2O(g)═H2(g)+ 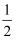 O2(g)△H=+485kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1
D . 2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣1
O2(g)△H=+485kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1
D . 2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣1
 减少的是( )
减少的是( )
 ,将其转化为氮肥
B . 大力推广使用风能、水能、氢能等清洁能源
C . 大力推广使用干冰实现人工增雨,缓解旱情
D . 通过植树造林,利用光合作用吸收大气中的
,将其转化为氮肥
B . 大力推广使用风能、水能、氢能等清洁能源
C . 大力推广使用干冰实现人工增雨,缓解旱情
D . 通过植树造林,利用光合作用吸收大气中的 
| 选项 | 操作和现象 | 结论或目的 |
| A | 将饱和的 | 制备 |
| B | 向钠与水反应形成的溶液中滴加几滴酚酞,溶液变红 | 钠与水反应生成了碱 |
| C | 向 | 沉淀为 |
| D | 向某溶液中通入 | 原溶液中一定含有 |
-
(1) I.制备氢气
制备氢气常采用以下方法:
①电解水法:2H2O
 2H2↑+O2↑
2H2↑+O2↑②水煤气法:C+H2O(g)
 CO+H2 , CO+H2O
CO+H2 , CO+H2O  CO2+H2↑
CO2+H2↑③太阳能光催化分解水法:2H2O
 2H2↑+O2↑
2H2↑+O2↑三种方法中最节能的是(填标号)。
-
(2) 已知拆开1 mol H -H、1 mol O=O和 1 mol H-О分别需要的能量依次为436kJ、498kJ和463kJ,则理论上每3.6 gH2O(g)完全分解,需(填“放出”或“吸收")能量kJ。下列能正确表示该过程的能量变化示意图的是(填标号)。

-
(3) II.氢燃料电池
氢燃料电池具有清洁高效等优点,其简易装置如下图所示。

该电池正极反应式为;反应过程中将能转化为能。
A.化学键没有被破坏的是;
B.仅发生离子键破坏的是;
C.仅发生共价键破坏的是;
D.既发生离子键又发生共价键破坏是.
-
(1) I.制备银镜
下列有关制备银镜过程中的相关描述错误的有____(填标号)。
A . 边振荡盛有2%的 溶液的试管,边逐滴滴入2%的氨水,使最初产生的沉淀溶解,得到银氨溶液
B .
溶液的试管,边逐滴滴入2%的氨水,使最初产生的沉淀溶解,得到银氨溶液
B .  是配位化合物,配位原子是N,中心离子的配位数是2
C . 将几滴银氨溶液滴入2mL乙醛中,用酒精灯的外焰给试管底部加热,一段时间后,产生银镜
D . 只有醛类物质才能发生银镜反应
是配位化合物,配位原子是N,中心离子的配位数是2
C . 将几滴银氨溶液滴入2mL乙醛中,用酒精灯的外焰给试管底部加热,一段时间后,产生银镜
D . 只有醛类物质才能发生银镜反应
-
(2) II.去除银镜
用一定浓度的
 去除银镜,此法的缺点是。
去除银镜,此法的缺点是。 -
(3) 利用
 溶液去除银镜:
溶液去除银镜:i.配制溶液:配制
 溶液时,需用到的玻璃仪器除了烧杯、量筒、胶头滴管、玻璃棒外,还有①。
溶液时,需用到的玻璃仪器除了烧杯、量筒、胶头滴管、玻璃棒外,还有①。ii.将
 溶液(pH≈2)加入有银镜的试管中,充分振荡,银镜部分溶解。于是,进行如下相关实验探究。
溶液(pH≈2)加入有银镜的试管中,充分振荡,银镜部分溶解。于是,进行如下相关实验探究。猜想a:
 氧化了Ag;猜想b:
氧化了Ag;猜想b: 时,
时, 氧化了Ag
氧化了Ag为验证猜想,设计如下实验。
(限选试剂:A.
 溶液
溶液 B.
B. 溶液C.
溶液C. 溶液
溶液 D.
D. 溶液)
溶液)操作
现象
结论
取少量上述溶解银镜后的溶液,滴加几滴
 溶液
溶液②
猜想a成立,溶解银镜的离子方程式为③
将④(填试剂对应标号)两种溶液等体积混合,取4mL混合溶液,加入有银镜的试管中,充分振荡
银镜不溶解
猜想b不成立
-
(4) 利用
 溶液去除银镜:将
溶液去除银镜:将 溶液,加入有银镜的试管中振荡,银镜全部溶解,且有白色沉淀产生。将分离得到的白色沉淀置于试管中,滴加氨水,沉淀溶解,该沉淀溶解的离子方程式为。
溶液,加入有银镜的试管中振荡,银镜全部溶解,且有白色沉淀产生。将分离得到的白色沉淀置于试管中,滴加氨水,沉淀溶解,该沉淀溶解的离子方程式为。
-
(5) 相同条件下,
 溶液比
溶液比 溶液去除银镜更彻底,其原因是。
溶液去除银镜更彻底,其原因是。
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验 |
| D | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
已知A~G是几种烃分子的球棍模型,据此回答下列问题:

(1)如图七种烃中:
①常温下含氢量最高的气态烃是 (填对应结构简式).
②能够发生加成的烃有 种.
③分子中所有原子共面的是 (填对应字母).
④属于芳香烃的是 (填对应分子式)
(2)由D可制取重要的化工原料聚氯乙烯,其中涉及到的反应类型有2种,依次是 和 .
下列化学反应在冶金工业中没有得到广泛应用的是 ![]()
A.MgC12(熔融)![]() Mg+C12↑ B.A12O3+3C
Mg+C12↑ B.A12O3+3C ![]() 2A1+3CO↑
2A1+3CO↑
C.Fe2O3+3CO![]() 2Fe+3CO2 D.2Ag2O
2Fe+3CO2 D.2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
在一定温度下,发生如下反应:N2+3H2
和H2的物质的量分别是3.0 mol和6.0 mol,平衡时生成NH3的物质的量是2.4 mol。
已知容器的容积为5.0 L,试求:(1)H2的转化率。(2)平衡时混合气体中N2的体积分数。
等温等压时,等质量的CH4与X气体的体积比为15 : 8 ,则X气体的摩尔质量
为______
将一小块钠投入到FeCl3溶液中,观察到的现象是( )
A.钠溶解,有铁析出并有气体产生 B.只有气体产生
C.既有气体产生,又有红褐色沉淀产生 D.只有沉淀产生
下列分子中,所有原子均在同一平面的是
A.甲醛 B.甲苯 C.一氯甲烷 D.2甲基丙烯
下列说法正确的是![]()
![]()

A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点![]() 的数值比b点
的数值比b点![]() 的数值大
的数值大
C. 由图丙可知,反应![]() 是吸热反应
是吸热反应
D. 由图丁可知,反应![]() 金刚石,
金刚石,![]() 石墨,
石墨,![]() 的焓变
的焓变![]()
- 2010年3月5---14日,十一届全国人大三次会议在北京举行。3月14日上午 第十一届全国人民代表大会第三次会议在批准
- 在直角坐标系xOy中,点P(xP,yP)和点Q(xQ,yQ)满足按此规则由点P得到点Q,称为直角坐标平面的一个“点变换”
- 阅读下列文段,完成文后问题。 祖传青瓷碗①落日照着那只旧船一起一伏,芦竹映衬着这古朴的木刻的景色。老人一动不动
- 核酸是细胞内携带遗传信息的物质,以下关于DNA和RNA特点的比较,正确的是 A.在细胞内存在的主要部位相同
- 请根据构造原理,写出下列元素基态原子的电子排布式:(1)C 。(2)Ne
- 根据体质方面的特征人类可以分为 ,黄种人和 。
- 从2009年2月1日起,财政部、商务部、工业和信息化部决定,在全国花4年时间全面推广“家电下乡”工程,农民购买“家电下乡
- 阅读下面二则材料,根据要求作文。(60分) 一、美神维纳斯的雕像双臂残失,许多艺术家想使她复原,但所有的方案都难尽
- 下列叙述中不正确的是A.在单克隆抗体上连接抗癌药物制成生物导弹,既可以消灭癌细胞,又不伤害健康细胞B.利用植物组织培养技
- (本小题满分10分) 已知函数且函数的最小正周期为;
- Mumsays ______ I do my homework now, I can watch TV for an h
- 下列属于生态系统食物网特征的是 A.一种生物只能被另一种生物捕食 B.食物链的环节数是无限的C
- 下列有关人体细胞内的化学反应,可不在细胞器中进行的是 A.CO2的生成 B.ATP的生成 C.mRNA的合
- 若,则的值为( ) A.-1 B.3 C.6 D.5
- 阅读理解 ,阅读下面两篇短文,根据短文内容,选择最佳选项。There are over 800 boarding (寄宿
- 关于太阳的叙述正确的是( ) A.太阳是距离地球最近的天体 B.能量来自内部的核裂变反应 C
- I can’t stand him.He always talks as though he everythin
- 已知一次函数y=2x﹣b与两个坐标轴围成的三角形面积为9,则b=__________.
- 1992年,大陆海峡两岸关系协会与台湾海峡交流基金会就海峡两岸关系达成共识。其内容是两岸均坚持 A、一个中国
- 美国把21世纪视为维持其“一超”地位的机遇期;本世纪初,俄罗斯提出未来5年是实现其强国战略的“重大考验期”;日本制定了“
 溶液滴加到浓
溶液滴加到浓  溶液中
溶液中 胶体
胶体 溶液中加入一小块钠,生成气体和沉淀
溶液中加入一小块钠,生成气体和沉淀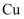
 ,再加入
,再加入  溶液,溶液变红色
溶液,溶液变红色




