高中 化学
(i) I2(g)+H2(g)⇌2HI(g)+9.48kJ
(ii) I2(s)+H2(g)⇌2HI(g)﹣26.48kJ,下列判断正确的是( )
 溶液中加入过量盐酸:
溶液中加入过量盐酸:  B . 将NaOH投入足量
B . 将NaOH投入足量  饱和溶液中:
饱和溶液中:  C . 铜与稀硝酸的反应:
C . 铜与稀硝酸的反应:  D . 向碳酸氢钠溶液中滴加少量石灰水:
D . 向碳酸氢钠溶液中滴加少量石灰水: 
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是( )
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是( )
 溶液的变化曲线
B . a处溶液的导电能力几乎为0,所以
溶液的变化曲线
B . a处溶液的导电能力几乎为0,所以 是非电解质
C . c点两溶液中
是非电解质
C . c点两溶液中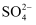 的物质的量关系:①
的物质的量关系:① ②
D . b~d的离子方程式为
②
D . b~d的离子方程式为

选项 | 生产活动 | 知识解读 |
A | 用干冰进行人工降雨 | 干冰升华吸热 |
B | 用生石灰作食品干燥剂 | 生石灰吸水,易与水反应 |
C | 向葡萄酒中通入少量 |
|
D | 利用氢氟酸刻蚀石英制作艺术品 | 氢氟酸可与 |
工业用铝上矿(组成: 主要Al2O3、还有Fe2O3、SiO2) 冶炼铝流程如下:

完成下列问题:
(1)填主要成分的化学式: 滤液A_______;滤渣B______;固体D_______。
(2)流程中每一步加入试剂都足量,X是无色无味无毒气体,X为_______。滤液B通入X气体生成沉淀的离子方程式________________。
(3)滤液A 加入足量的NaOH溶液过程中反应的离子方程式(不考虑过量盐酸的反应):________;____________。
(4)铝热反应可以焊接钢轨,写出铝与氧化铁用于焊接钢轨的化学方程式__________。
运用相关原理,回答下列各小题:
I.已知:硫酸氢钠在水中的电离方程式为___________________________
(1)常温下,pH=5的硫酸氢钠溶液中水的电离程度______pH=9的一水合氨中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的硫酸氢钠与氨水混合后,溶液呈酸性的原因为______。(用离子方程式表示);若一定量的硫酸氢钠溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+)___2c(SO42-)(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的PH_____7(填“>”、”=”或“<”)
II.25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO, c.CH3COONa d.NaHCO3;pH由大到小的顺序是:_______________________;(填编号)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中,c(CH3COO-)-c(Na+)=_____________。(填准确数值)
(1)如图是石油分馏塔的示意图。a、b、c三种馏分中________(填字母序号)。

A.a的沸点最高
B.b的熔点最低
C.c的平均相对分子质量最大
D.每一种馏分都是纯净物
(2)裂化汽油中除含有C5~C11的烷烃外,还含有C5~C11的烯烃及甲苯、二甲苯等苯的同系物。已知甲苯、二甲苯能使酸性KMnO4溶液褪色。要用化学方法检验某裂化汽油样品中含有烯烃及苯的同系物,实验步骤为:
①先逐滴加入________,振荡,如果看到________,则证明有________存在;
②继续逐滴加入________至________为止,静置,用分液漏斗分出________(填“上”或“下”)层的裂化汽油样品,再加入________振荡,如果看到________,则证明裂化汽油中有________存在。
下列物质中,不含有硅酸盐的是( )
A.水玻璃 B.硅芯片
C.黏土 D.普通水泥
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mo1CH4中的氢原子被氯原子完全取代,共需要2NA个Cl2分子
B.常温常压下,mg乙烯与mg丙烯的体积相同
C.标准状况下,22.4 L苯所含的分子数为NA
D.46g乙醇与足量的金属钠反应,生成的气体在标准状况下的体积约为11.2L
如图是常见四种有机物的比例模型示意图.下列说法正确的是( )

A. 甲能使酸性高锰酸钾溶液褪色
B. 乙可与溴水发生加成反应使溴水褪色
C. 丙中的碳碳键是碳碳单键和碳碳双键交替结合
D. 丁在稀硫酸作用下可与乙酸发生取代反应
- 2010年4月15日,国家科技教育领导小组会议审议并原则通过《国家中长期教育改革和发展规划纲要(2010~2020年)》
- 某生物兴趣小组利用玉米胚芽鞘做了如下图所示实验。对实验的叙述正确的是( )A.在该实验中可以不设计B琼脂块的相关实验
- (本题满分8分)随着人们经济收入的不断提高及汽车产业的快速发展,汽车已越来越多地进入普通家庭,成为居民消费新的增长点.据
- 已知某温度时CH3COOH的电离平衡常数为K。该温度下向20mL 0.1mol・L-1CH3COOH溶液中逐滴加入0.1
- 图反映的进步潮流出现在A.洋务运动时期 B.维新变法时期 C.辛亥革命时期 D.新文化运动时期
- (共10分)有理数、在数轴上对应点如图所示:【小题1】(1)在数轴上表示、|y|;【小题2】(2)试把、、0、、︱y︱这
- 阅读下面的科普材料。 地球上的金属资源广泛存在于地壳和海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化
- Dad is used to smoking and drinking. There’s no chance _____
- 由亍污染增多,污染物进入北极熊体内使其体型缩小;全球气候变暖,北极熊要花费更多的能量猎食.这就限制了它的生长。下列选项中
- —Thanks ______ joining the Talk Show!—You're welcome. A. b
- --- How soon will you start your journey? --- I'm not sure
- 下列语句中加点的成语使用不正确的一项是( ) A.做任何工作都不能孤军奋战,必须团结合作。众人拾柴火焰高,我们
- 27.下列关于细胞中无机物的说法正确的是( ) A.各种生物体的一切生命活动都离不开水 B.细胞中无机盐都是
- 如图,△ABC中,AD是高,CE是角平分线, AD交CE于点P,已知,∠APE=550,∠AEP=1000,求△ABC的
- 在我们身边,下列各类物质存在最多的是 A.纯净物 B.混合物 C.单质
- 燃烧产物对环境影响最小的物质是( ) A.液化气 B.煤气 C.氢气 D.天然气
- 李师傅在某外资企业工作,3月底拿到了4000元的工资款。这“4000元”() A.属于社会主义个人消费品分配形式
- 第十一届中国国际环保展览暨会议于2009年6月3日至6日在北京举行。海外展商有包括美国、法国的23个国家和地区。大会的主
- 下列有关文学常识的表述,错误的一项是 A. 海伦·凯勒(Keller,Helen 1880-1968),二十世纪最伟大的
- 侯银匠 汪曾祺 侯银匠店特别处是附带出租花轿。银匠店出租花轿,不知是什么道理。 侯银匠中年丧妻,身边只有一个女儿侯菊。在
 进行防腐,起到保质作用
进行防腐,起到保质作用 反应
反应


