高中 化学

-
(1) Mg2Al(OH)6Cl•xH2O热分解的化学方程式为.
-
(2) 若只通过测定装置C、D的增重来确定x,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是.装置连接后,首先要进行的操作的名称是.
-
(3) 加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是、等.
-
(4) 完全分解后测得C增重3.65g、D增重9.90g,则x=.若取消冷却玻管B后进行实验,测定的x值将(填“偏高”或“偏低”).
-
(5) 上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1﹣2x(CO3)y•zH2O],该生成物能发生类似的热分解反应.现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定.
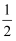 O2(g)=H2O(g)△H1
O2(g)=H2O(g)△H1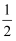 N2(g)+O2(g)=NO2(g)△H2
N2(g)+O2(g)=NO2(g)△H2
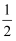 N2(g)+
N2(g)+  H2(g)=NH3(g)△H3
H2(g)=NH3(g)△H3
则反应2NH3(g)+  O2(g)=2NO2(g)+3H2O(g)的△H为( )
O2(g)=2NO2(g)+3H2O(g)的△H为( )

(1)钠元素的金属性比铝的(填“强”或“弱”).
(2)将一小块金属钠投入水中,发生反应的离子方程式为 ;可观察到的实验现象是 (填序号).
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是 .将该产物溶于水配成溶液,分装在两支试管中.请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成 色.
b.向另一支试管中滴加NaOH溶液,现象为 ,反应的离子方程式是 .
 实验室用装置制取氨气
B .
实验室用装置制取氨气
B .  用装置吸收氨气,并防止倒吸
C .
用装置吸收氨气,并防止倒吸
C .  用装置稀释浓硫酸
D .
用装置稀释浓硫酸
D .  用装置除去CO2中的HCl
用装置除去CO2中的HCl
(2)能证明Na2SO3溶液中存在SO32﹣+H2O⇌HSO3﹣+OH﹣水解平衡的事实是 (填选项字母).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(3)现有可逆反应:2A(g)+2B(g)⇌C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol,Ⅱ.C、D的起始物质的量分别为2mol和6mol.以下说法中正确的是 (填选项字母).
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径Ⅱ中C的平衡浓度大于途径Ⅰ中C的平衡浓度的2倍
(4)在恒容绝热(不与外界交换能量)条件下进行2A (g)+B(g)⇌2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.简述该反应的平衡常数与温度的变化关系: .
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
(1)将固体混合物溶于水中,搅拌后得无色透明溶液;
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解。
试判断,固体合物中肯定有______,肯定没有______,可能有______。对可能有的物质可采用滤液中滴加_______溶液的方法来检验。
某学生在实验室分别取50 mL0.50 mol/L盐酸和50 mL0.55 mol/LNaOH溶液用下图所示装置进行测定中和热的实验,并将实验数据记录如下:
| 实验次数 | 起始温度t1/℃ |
t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 。
(2)经数据处理,t2-t1= 3.4 ℃。则该实验测得的中和热ΔH = _
(3)假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL
0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
短周期元素的四种离子A3+、B+、C―、D2―,均具有相同的电子层结构:
它们的原子半径由大到小的顺序为 ;
它们的原子序数由大到小的顺序为 。
NA代表阿伏加德罗常数值,下列说法正确的是
A.标准状况下,11.2 L SO3所含的分子数为0.5 NA
![]() B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
![]() C.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数一定为0.25NA
C.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数一定为0.25NA
D.6.4gCaC2晶体中含有0.1NA个阴离子
. 某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:

物质X的化学式为________,操作1的名称:_________
写出A中主要成分的化学式:_______________,在A中加入Y的离子方程式为:__________________________________________
工业废水中加入X所发生的离子方程式为:__________________________________;是否氧化还原反应_______________(填“是”或“否”),如果是氧化还原反应,发生还原反应的是:______________(若非氧化还原反应不填)
操作中的操作3是:___________、冷却结晶、过滤、洗涤、烘干。
下列关于有机物的说法中,不正确的是
A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖
某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)该配位化合物的化学式为 ,配合物中采取sp3杂化的原子按第一电离能由大到小排列顺序为 (用元素符号表示),1mol配离子中含有的σ键数目为 。
(2)D元素基态原子的最外层电子排布图为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_________________________________。
(4)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,该分子中B元素的杂化方式为________。
(5)该配合物溶于水得深蓝色溶液,加入乙醇溶剂,将析出深蓝色的晶体,则加入乙醇的作用是 。
N2的分子结构可表示为![]() ,CO的结构可以表示为
,CO的结构可以表示为![]() ,其中椭圆框表示π键,下列说法不正确的是( )
,其中椭圆框表示π键,下列说法不正确的是( )
A、N2分子与CO分子中都含有三键
B、N2分子与CO分子中的π键并不完全相同
C、N2分子与CO分子互为等电子体
D、N2分子与CO分子的化学性质相同
.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
| 选项 | A | B | C | D |
| 物质 | CO2 | MgCl2 | HCl | NH4Cl |
| 所含化学键类型 | 共价键 | 离子键、共价键 | 离子键 | 共价键 |
| 所属化合物类型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
从化学看生活,你认为下列说法合理的是( )
A.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
B. Cu的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C. “84消毒液”可用于消毒、漂白,说明其具有强还原性
D. H2还原氧化铁,Mg还原CO2,反应类型均为复分解反应
- 直线y=kx-1一定经过点( ) A.(1,0) B.(1,k) C.(0,k)
- 一个等比数列的前3项的积为2,后三项的积为4,且所有项的积为64,则该数列共有 A.6项
- 动物生活所需要的营养物质最终来自于
- 下列说法或表述正确的是( )A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B.由单质A转化为单质B是一个
- 已知是不重合的直线,是不重合的平面,有下列命题: ①若,则;②若,则; ③若,则;④若,则 其中所有真命题的序号是
- 在离体条件下单条神经纤维的电位示意图如下,下列叙述正确的是 A.a—b段Na+的内流是需要消耗能量的 B.b—c段Na+
- 生物体内葡萄糖代谢过程的图解如下,据图可知下列有关说法正确的是A.反应①②④都可在人体细胞中进行 B.无氧条件下,酵母菌
- 一辆m=2000kg的汽车在水平公路上行驶,经过半径r=50m的弯路时,如果车速v=72km/h,这辆汽车会不会侧滑?已
- —I often see him working hard in hisspare time. —________he
- 一艘轮船,于2010年1月10日上午10点从上海港起航,经过了7整天后越过印度洋到达伦敦,问到达时到达地的时间是几月几日
- 某几何体的三视图如图所示,则该几何体的体积为 .
- 以“劲头”与“甜头”为话题写一篇作文
- We all know the importance of curiosity, and here are som
- 直线l过点( 0,2 )且与双曲线x 2y 2 = 6的右支有两个不同的交点,则l的倾斜角的取值范围是( )(A)(
- --John has got a very good job in the government. --- _____
- (6分)下面是制作洋葱鳞片叶表皮细胞临时装片的方法步骤图,请回答下列问题。(1)制作洋葱鳞片叶表皮细胞临时装片正确的实验
- 在原子中,决定原子质量大小的主要是 A.质子数和中子数 B.质子数和电子数 C.中
- Chinesecompany iQiyi has grown into one of the country’s bi
- 设关于x,y的不等式组表示的平面区域内存在点P(x0,y0),满足x0-2y0=2,则的取值范围是
- (12分)将6.4 g 铜加入到50 mL a mol/L的硝酸溶液中,铜全部溶解,得到NO2和NO的混合气体。将反应后




