高中 化学
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O 2H2↑+O2↑.制得的氢气可用于燃料电池.试完成下列问题:
2H2↑+O2↑.制得的氢气可用于燃料电池.试完成下列问题:
太阳光分解海水时,实现了从 能转化为 能,二氧化钛作 生成的氢气,用于燃料电池时,实现 能转化为 能.分解海水的反应属于 反应(填“放热”或“吸热”).
 、MnO
、MnO  B . Mg2+、Na+、Cl-、SO
B . Mg2+、Na+、Cl-、SO  C . K+、Na十、Br-、Cu2+
D . Na十、Ba2+、OH-、SO 4 2 −
C . K+、Na十、Br-、Cu2+
D . Na十、Ba2+、OH-、SO 4 2 −
 =BaSO4↓+H2O
B . 向CaCl2溶液中通入足量CO2:Ca2++H2O+CO2=2H++CaCO3↓
C . 向NH4HCO3溶液中加入过量NaOH溶液:HCO
=BaSO4↓+H2O
B . 向CaCl2溶液中通入足量CO2:Ca2++H2O+CO2=2H++CaCO3↓
C . 向NH4HCO3溶液中加入过量NaOH溶液:HCO +OH-=CO
+OH-=CO +H2O
D . 二氧化锰和浓盐酸反应:MnO2+4H++2Cl-
+H2O
D . 二氧化锰和浓盐酸反应:MnO2+4H++2Cl- Mn2++Cl2↑+ 2H2O
Mn2++Cl2↑+ 2H2O
-
(1) 100t该煤含S的物质的量为mol。
-
(2) 假设煤中的硫全部转化为SO2 , 每天产生的SO2气体在标准状况下体积为L。
-
(3) 若把产生的SO2全部用来生产硫酸,每天可得到98%的浓硫酸质量吨(请写出计算过程)

已知:a.化合物G中除苯环还有其它环
b. ![]()

![]()
c.ROR1  RX
RX  RCOOH
RCOOH
完成下列填空:
-
(1) 写出①的反应类型。
-
(2) C中含氧官能团名称。
-
(3) 写出E的结构简式为。
-
(4) H发生消去反应所需的试剂和条件。
-
(5) 写出F → G的化学方程式。
-
(6) 写出满足下列条件,D同分异构体的结构简式。
①能发生银镜反应;②苯环上的一卤代物只有一种
-
(7) 设计从芳香烃A到B的合成路线(其它无机试剂任选) 。 (合成路线常用的表达方式为:A
 B
B  目标产物)
目标产物)
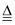 MnCl+2H2O+Cl2↑
C . 2KNO3
MnCl+2H2O+Cl2↑
C . 2KNO3 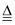 2KNO2+O2↑
D . NH4NO3
2KNO2+O2↑
D . NH4NO3 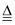 N2O↑+2H2O
N2O↑+2H2O

下列说法错误的是( )

| 选项 | 气体 | 液体 | 喷泉颜色 |
| A | Cl2 | 饱和食盐水 | 黄绿色喷泉 |
| B | NH3 | 含有酚酞的H2O | 红色喷泉 |
| C | HCl | AgNO3溶液 | 白色喷泉 |
| D | CO2 | 含有酚酞的NaOH溶液 | 红色喷泉 |

-
(1) 降冰片烯属于.
A 环烃 B 不饱和烃 C 烷烃 D 芳香烃
-
(2) 降冰片烯的分子式为.
-
(3) 降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为.
-
(4) 降冰片烯不具有的性质.
A 能溶于水 B 能发生氧化反应
C 能发生加成反应 D 常温常压下为气体.

下列有关叙述正确的是( )
某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子,请写出其结构简式。
向下列各物质水溶液中滴加稀硫酸或氯化钙溶液时,均有白色沉淀生成的是
A.NaOH B.Na2CO3 C.NaCl D.Na2SiO3
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(![]() MnCO3)。其工业流程如下图所示:
MnCO3)。其工业流程如下图所示:

(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为___(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:___。

(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是__。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀![]() ,同时还有CO2气体生成,写出反应的离子方程式:_。
,同时还有CO2气体生成,写出反应的离子方程式:_。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是__。
某可逆反应A(g) ![]() 2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA ,甲容器中3min后B的浓度达到0.12mol/L保持不变,乙容器中2min后C的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )
2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA ,甲容器中3min后B的浓度达到0.12mol/L保持不变,乙容器中2min后C的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )
A.甲容器中温度比乙容器高 B.乙容器中温度比甲容器高
C.乙容器中使用了催化剂 D.甲容器中使用了催化剂
- 在中国古代史上,世袭制代替禅让制,“公天下”变成“家天下”从历史发展的角度看 A.这是一种进步
- The other day Iheard a few local musicians talking: “I hate
- ---Is there anything wrong, Bob? You look sad. ---Oh, nothin
- 选出词语依次填空最恰当的一项 他( )下桅杆,( )起了帆,把它( )上,然后把桅杆( )在肩上,顺着堤坡往岸上走去
- 我们的生活离不开水。下列有关水的认识中错误的是A.自然界中的水都是混合物B.可用肥皂水来区分硬水和软水C.使用无磷洗衣粉
- 2014年5月,一个国际科研团队宣布其用钙原子轰击放射性元素锫,成功合成117号元素(部分信息如图所示)。下列说法错误的
- 最近韩剧《太阳的后裔》跨越韩国,在中国大陆刮起了人气飓风,甚至超过了《来自星星的你》的人气,刮起了一阵新的韩剧追捧风。受
- 四川内江 阅读下文,完成9-12题。(13分) 味蕾上绽放的爱 ○黎 明 1记得一位老同事,每次
- — I bought the furniture at half the price. — We
- 求函数解析式.(1)已知f(+1)=x+2,求f(x),f(x+1),f(x2);(2)已知二次函数f(x)满足f(
- 下列常见盐在生产、生活中的用途不合理的是 ( ) A.用亚硝酸钠腌制食品 B.用
- 生态旅游是以自然为基础,涉及自然环境的教育、解释与管理。使之在生态上可持续地发展。下列建议或认识不合理的是() A. 提
- 如图,Rt△ADE≌ Rt△BEC, ∠A =∠B =90°,使A、E、B在 同一直线上,连结CD. (1)求证:∠
- Much to the excitement of fans, South Korean boy band Dong B
- 课内阅读(13分)不必说碧绿的菜畦,光滑的石井栏,高大的皂荚树,紫红的桑葚;也不必说鸣蝉在树叶里长吟,肥胖的黄蜂(
- 决定元素化学性质的是原子的 A. 最外层电子数 B. 中子数 C. 相对原子质量 D.
- 如图,已知点为矩形边上的一点,作于,且满足.下面结论①;②;③;④.其中正确的结论是:_____________(只填序
- 由于美国房价年年攀升,在次级信贷市场贷款的人,可以拿房价升高的差价来填补信贷;但当房价持平时,信贷人难以有中间差价按时还
- 有关人体的组成元素的说法中错误的是() A.组成人体自身的元素约有60多种B.人体内的碳、氢、氧、氮四种元素主要以水
- 能用带磨口玻璃塞的试剂瓶保存的溶液是( ) A.烧碱溶液 B.胆矾溶液



