高中 化学
(i)KBrO3能将KI氧化成I2或KIO3 , 其本身被还原为Br2 .
(ii)Br2能将I-氧化为I2 .
(iii)KIO3能将I-氧化为I2 , 也能将Br-氧化为Br2 , 其本身被还原为I2 .
①上述物质中氧化剂氧化能力由强到弱的顺序是.
②现向含有1molKI的硫酸溶液中加入含amolKBrO3的溶液,a的取值范围不同,所得产物也不同.试将讨论的结果填入下表.
编号 | a的取值范围 | 产物的化学式或(离子符号) |
A | I2 , Br- | |
B |
| |
C | a= | |
D | I2 , IO3- , Br2 | |
E | a≥ |
③若产物中碘单质和碘酸钾的物质的量相等,a的值为.
④若a的值为1时,其产物及其物质的量分别为.

下列说法错误的是( )
①a﹣b=m﹣n ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y.
 NaCl+H2O+NH3↑
B . CH4+2O2
NaCl+H2O+NH3↑
B . CH4+2O2  CO2+2H2O
C . 2Al+Fe2O3
CO2+2H2O
C . 2Al+Fe2O3  Al2O3+2Fe
D . 3Cl2+2Fe
Al2O3+2Fe
D . 3Cl2+2Fe  2FeCl3
2FeCl3
.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
(B)用标准溶液润洗滴定管2-3次;
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
(E)调节液面至0或0刻度以下,记下读数;
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________。
(2)实验中用左手控制_________(填仪器及部位),眼睛注视_______,直至滴定终点。判断到达终点的现象是___________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是____________。
(5)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______。
在标准状况下,下列物质所占体积最大的是( )
A.98 g H2SO4 B.56 g Fe
C.44.8 L HCl D.6 g H2
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________________;
__________________________________________。
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是_____________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中氢气生成速率,还可采取的措施有___________________________
____________________________________________________________ (答两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________________________________________________________
________________________________________________________________________。
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到−3价。某同学取一定量的铁铝合金与一定量很 稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的
稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的![]() 溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴ 写出该合金中铁与硝酸反应的离子方程式
;
⑵ 图中OC段无沉淀生成,此阶段反应的离子方程式为 ;
⑶ DE段发生反应的离子方程式为 ;
⑷ B与A的差值为______ mol;
⑸ B点对应的沉淀的物质的量为 mol,C点对应的NaOH溶液的体积为
mL。
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) ![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
 (1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
a.v消耗(CH3OH)=2 v消耗(H2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡时c(H2)/ c(CH3OH)减小
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )

A.a-b-c-d-e-f-g-h
B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g
D.a-c-b-d-e-h-i-f
下列说法中错误的是( )
![]()
![]() A.苯乙烯( —CH=CH2)与立方烷( )互为同分异构体
A.苯乙烯( —CH=CH2)与立方烷( )互为同分异构体
B.苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键
C.甲烷中混有的乙烯可以用溴的四氯化碳溶液除去
D.医院用75%酒精杀菌、消毒,75%是指质量分数
. 有关下列四个常用电化学装置的叙述正确的是 ( )




图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2![]() 的作用是催化剂
的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
某10%NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20%NaOH溶液的物质的量浓度为
A.6.25mol/L B.12.5mol/L C.7mol/L D.7.5mol/L
选项 | 现象或事实 | 解释 |
A | 医疗上用75%的乙醇做消毒剂 | 乙醇具有易挥发性 |
B | 用Na2S除去废水中的Cu2+和Hg2+ | Na2S具有强还原性 |
C | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 高锰酸钾可氧化水果释放的乙烯 |
D | 用明矶溶液清除铜镜表面的铜锈 | 明矾溶液中Al3+产能与铜锈反应 |
A. A B. B C. C D. D
A. 互为同位素 B. 化学性质相同 C. 质量数不同 D. 核外电子数不同
- 总书记在关于树立社会主义荣辱观的讲话中,提出了“八荣八耻”的要求,其中要求我们“以艰苦奋斗为荣,以骄奢淫逸为耻”。今天之
- 如图所示是小明在探究甲、乙、丙三种物质的质量与体积关系时作出的图像,分析图像可知( )A.ρ甲>ρ乙>
- 针对美国队台军售、奥巴马会见达赖等问题,中国政府提出强烈抗议。这体现我国外交政策的基本目标是 A.维护国家主权和独立
- 以粗盐为原料生产ClO2(可用于自来水消毒)的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺
- 雄果蝇的精子中含有的染色体组数目是 ( ) A.一个 B.两个
- 下列句中加点的成语,运用正确的一项是( ) A.遇到不明白的地方,他都及时向老师请教,非要弄个水落石出才罢休。 B
- 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()
- 在文化建设中,高举中国特色社会主义伟大旗帜,最根本的是 A. 贯彻落实科学发展观 B. 开辟
- 有七种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷⑦环已烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因
- 在下面外国侵略者发动的侵华战争中哪次攻进了北京城并大肆抢劫 ( ) ①鸦片战争 ②第二次鸦片战争
- 已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水。有人设计下图所示装置(A中盛有饱和NaNO2、NH4Cl的混合溶液
- 单词拼写:(每小题1分,共10小题) In less than two days 100,000 pieces were
- 下列物质属于化合物的是 A.HCl B.O2 C.氯水 D.
- 下图的框图是一古代数学家的一个算法的程序框图,它输出的 结果s表示( ) A、的值 B、的
- (2013哈尔滨三中月考)如图所示,两个倾角相同的滑竿上分别套有A、B两个圆环,两个圆环上分别用细线悬吊两个物体C、D,
- (+)+=_______________.
- 十一届三中全会后,深圳、珠海、汕头、厦门成为我国第一批经济特区这些经济特区发展经济的有利客观条件是 ( ) ①靠近港
- 东欧国家动荡不安的1989年,法国在进行它的200周年国庆纪念活动,7月14日,他们用飞机洒下了法国人引以为豪的“献给人
- “要实现中国梦,必须弘扬中国精神,这就是以爱国主义为核心的民族精神,以改革创新为核心的时代精神。”二者间 ①相辅相成,
- 右图是一个几何体的三视图,则这个几何体是A.圆锥B.圆柱C.长方体D.球体
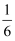 <a<
<a<