高中 化学
| IA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
-
(1) ④、⑤、⑥的原子半径由大到小的顺序为(填元素符号);
②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。
-
(2) ①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:。
-
(3) 由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)。
a.MnO2
b.FeCl3
c.Na2SO3
d.CaCO3
-
(4) 由表中元素形成的物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为。
①加热
②滴入稀硫酸
③加入新制的氢氧化铜悬浊液
④加入适量的氢氧化钠溶液调节至碱性
选项 | 实验目的 | 实验操作 |
A | 证明乙烯有还原性 | 将乙烯气体通入酸性KMnO4溶液中 |
B | 比较H2O和乙醇中羟基氢的活泼性 | 分别加入少量Na |
C | 检验溴乙烷中的溴原子 | 加入NaOH溶液,加热,然后加入AgNO3溶液 |
D | 鉴别1﹣丙醇和2﹣丙醇 | 核磁共振氢谱 |

 Na2CO3+H2O+CO2↑
C . 2Na2O2+2CO2=2Na2CO3+O2
D . 4Fe(OH)2+O2+2H2O=4Fe(OH)3
Na2CO3+H2O+CO2↑
C . 2Na2O2+2CO2=2Na2CO3+O2
D . 4Fe(OH)2+O2+2H2O=4Fe(OH)3
-
(1) Ca的原子结构示意图为
-
(2) ①Mg的熔点比Be的熔点 (填“高”或“低”);
②铍单质通常用金属镁在高温下还原氟化铍制得,写出此反应的化学方程式
③依据对角线规则Be的最高价氧化物对应对应水化物的性质与Al(OH)3相似,写出氢氧化铍溶于氢氧化钠溶液的离子反应方程式 (提示:铍酸化学式为H2BeO3).
-
(3) Ba在充足的空气中燃烧可以生成过氧化物,写出此过氧化物的电子式
-
(4) 碱金属Li的性质与碱土金属Mg相似,可以在加热条件下与N2化合生成氮化锂,氮化锂与水反应的化学方程式 .若用此法来固氮,2.1kgLi最多可制得硝酸铵 kg.

已知:
Ⅰ.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2 , 呈碱性,与酸发生反应:CH3CH2NH2+H+=CH3CH2NH 
Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2CH3CH2NH  +WO
+WO 
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4
Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2 , 室温时,Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:
-
(1) TiOSO4中Ti的化合价是。
-
(2) “萃取”前,需要将“滤液Ⅰ”的pH调整到3.5左右,目的是。
-
(3) 写出“反萃取”步骤中生成(NH4)2WO4的化学方程式:,“过滤Ⅱ”所得滤液中,溶质的主要成分是(填物质名称)。
-
(4) 将“酸煮”所得TiOSO4溶液稀释到0.001mol·L-1 , 冷却至室温时恰好产生沉淀,此时溶液的pH为。
-
(5) 写出水解生成沉淀的离子方程式:,检验“过滤Ⅲ”所得H2TiO3是否洗涤干净的方法是。
-
(6) 最新研究发现,可以用如图所示装置由TiO2获得金属钛,电解质为熔融CaO。阳极的电极总反应式为:,在制备金属钛前后,装置中CaO的质量 (填“增大”“减小”或“不变”)。


 2H2O+2S↓
D . 若有1molH2S发生图示转化的同时消耗O2为0.4mol,则混合液中Fe3+浓度增大
2H2O+2S↓
D . 若有1molH2S发生图示转化的同时消耗O2为0.4mol,则混合液中Fe3+浓度增大

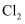 后,若氧化产物只有一种,反应的化学方程式为:
后,若氧化产物只有一种,反应的化学方程式为:  D . 过量
D . 过量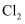 会将
会将 氧化为
氧化为 , 其反应的离子方程式为:
, 其反应的离子方程式为: 

-
(1) 写出A的名称以及B的化学式:
A、;B、;
-
(2) 写出有关反应的化学方程式
E→B:,
C→F:.
-
(1) X与L组成的最简单化合物的电子式为。
-
(2) X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
-
(3) Y在周期表中的位置是,其含氧酸的化学式为。
-
(4) L与M形成的化合物中L的化合价是。
向盛有碘化钾溶液的试管中加入少量氯水和CCl4后,充分振荡,可观察到液体分层,其中( )
A.上层紫色,下层无色
B.上层近无色,下层紫色
C.上层近无色,下层棕黄色
D.上层黄绿色,下层紫色
淡黄色粉末A跟无色液体B反应有无色气体C产生,金属D在C中燃烧可生成A,D跟B反应放出气体E,E和C又化合为B。从以上实验现象可判断(用化学式填空):
A ,B ,C ,D ![]() ,E ,
,E ,
A与B反应的化学方程式
为 ,此反应中 是氧化剂, 是还原剂。
下列物质在变化过程中,只需克服分子间作用力的是( )
A.食盐溶化 B.干冰升华
C.氯化铵受热,固体消失 D.石墨熔化
- 完型填空(共20 小题;每小题1分;满分20分) She was a four-year-old girl with v
- (本题12分)在如图所示的四面体ABCD中,AB、BC、CD两两互相垂直,且BC=CD=1。(1)求证:平面ACD⊥平面
- 20世纪70年代,拥有一辆“永久牌”自行车是很多人的梦想,如今很多人又做起了轿车梦。据此回答下面试题。 汽车已进入寻常百
- e found her greatly ___.A. improving B. changed C. to help D
- 新文化运动兴起的标志是( ) A 白话文小说的出现 B “文学革命”的提倡 C 《新青年》
- 如果以“追寻共和足迹”为主题出一期板报,下列素材可用的有( ) ①创建北洋海军
- 已知i为虚数单位,则z=在复平面内对应的点位于() A.第一象限 B.第二象限 C.第三象限 D.第四象限
- (几何证明选讲选做题) 如图,⊙O的直径, 是延长线上的一点,过点作⊙O的切线,切点为, 连接, 若,
- 把文言文阅读材料中画横线的句子译成现代汉语。(1)不能兴云雨,无以利世,而适类于予,然则虽辱而愚之,可也。
- 下列关于碳与碳的氧化物的说法不正确的是() A.木炭和一氧化碳都具有还原性 B.金刚石、石墨和C60都是碳元素的单质 C
- 在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识错
- 化学平衡问题研究对象主要是() A.化学反应 B.可逆反应 C.离子反应 D.气态物质的反应
- (1)证明:; (2)试结合(1)的结论,求的值. (可能用到的公式:)
- (18分)已知某链状有机物A的相对分子质量为72,根据下列条件回答下列问题(1)若该有机物只由碳、氢元素组成,则A的分子
- 如图是中国第一艘航空母舰“辽宁号”,该航母舰长304m,舰宽70.5m,排水量为6.75×104t,则满载时所受的浮力是
- 如图甲所示,一理想变压器初级线圈和次级线圈匝数比为2:1,初级接一灯泡L,次级接三个与L相同的灯泡L1、L2、L3,灯泡
- 我国公民享有广泛的政治权利和自由,其中基本的政治权利是( ) A、监督权 B、选举权和被选举权
- 假设你是李华,下个月你将去英国学习。请给你的笔友Peter写信,告诉 他你想利用周末时间参加社区志愿者活动,以便亲身体验
- 在生产上,利用音响设备发出不同的声信号诱捕或驱赶某些动物,使其结群或远离农田,这是利用了生态系统的功能() A.物质循环
- 能够统一天下的秦始皇,造出一个举世闻名的长城去防御敌人,却不能制造导弹去攻击敌人。从哲学角度看,这是因为实践具有( )



