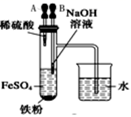
高中 化学
-
(1) 人体内提供能量的主要营养物质为 、糖类和蛋白质,人体内蛋白质在蛋白酶作用下水解的最终产物是
-
(2) 维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和剂共同完成.
-
(3) 咽喉发炎的病人可以使用药物 (填“氢氧化铝”或“青霉素”),起到杀菌消炎作用.
-
(4) 阿司匹林 在人体内可以水解为水杨酸和一种生活中常见的酸味剂,具有解热镇痛疗效,写出其水解的化学方程式:
下列关于有机物的说法错误的是( )
 B . 石油和天然气的主要成分都是碳氢化合物
B . 石油和天然气的主要成分都是碳氢化合物 C . 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
C . 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 D . 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
D . 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应

 )可用于医学、工业测量仪器以及水文学。下列有关
)可用于医学、工业测量仪器以及水文学。下列有关  的说法正确的是( )
的说法正确的是( )
-
(1) 麻黄素中含氧官能团的名称是基,
 属类化合物(填“醇”或“酚”)
属类化合物(填“醇”或“酚”)
-
(2) 下列各物质中
A.
 B.
B. 
C.
 D.
D. 
E.

与麻黄素互为同分异构体的是(填序号),互为同系物的是(填序号)
|
实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
盐酸体积/单位:mL |
50 |
50 |
50 |
50 |
|
样品质量/单位:g |
4.68 |
9.36 |
14.04 |
18.72 |
|
生成气体的体积(标准状况)/单位:L |
1.12 |
2.24 |
3.36 |
3.36 |
-
(1) 盐酸的物质的量浓度。
-
(2) 混合物样品中,NaHCO3与KHCO3的物质的量之比。
选项 | 操作 | 目的 |
A | 乙醇与浓硫酸加热至170℃,将产生的气体通入酸性高锰酸钾溶液 | 验证产物乙烯具有还原性 |
B | 向粗盐水中依次加入过量的BaCl2、NaOH、Na2CO3溶液,静置过滤,最后向滤液中滴加盐酸至无气泡产生 | 精制食盐水 |
C | 将醋酸与碳酸钠溶液反应后产生的气体通入苯酚钠溶液中 | 比较醋酸、碳酸、苯酚酸性 |
D | 淀粉溶液中加入几滴稀硫酸,水浴加热,充分反应后加入NaOH溶液调节至碱性,再加入银氨溶液,水浴加热· | 检验淀粉水解产物含有醛基 |
| | | | |
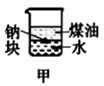
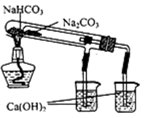
| A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)<ρ(钠)<ρ(水) | C.探究氧化性:KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3 , 的热稳定性 |

下列说法错误的是( )
以下是摘自高二实验班某学生在这次期中考试复习中对教材必修3第一章《原子结构》的总结,其中与教材说法不符的是
A.同一原子的能层越高,s电子云半径越大
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.书写电子排布式时,按照构造原理,依据电子的填充顺序从左到右书写能级
D.处于最低能量的原子叫做基态原子,我们通常所说的电子排布指的是基态原子的电子排布
元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.稀有气体元素 B.金属元素和非金属元素分界线附近的元素
C.过渡金属元素 D.元素周期表右上方区域的非金属元素
回答下列问题:
(1)写出实验室制NH3的化学方程式;
(2)写出铅蓄电池的负极电极反应式;
(3)写出Ba(OH)2·8H2O与NH4Cl晶体搅拌反应的化学方程式;
(4)画出稀有气体氪的原子结构示意图。
甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
⑴工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1![]()
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
⑵工业上可用CO和H2O (g) 来合成CO2 和H2,再利用⑴中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10![]() L固定密闭容器中进行化学反应:
L固定密闭容器中进行化学反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法![]() 是 。
是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
⑶甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
① a物质是 , A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
 |
下列相关化学与生活、生产的叙述错误的是( )
A.用作“钡餐”的物质主要成分是硫酸钡
B.采用催化设施,将汽车尾气中CO和NO转化为无害气体
C.常温下,可以用铁制容器来盛装冷的浓硫酸
D.SO2具有氧化性,可用于漂白纸浆
防冻剂是一种能在低温下防止物料中水分结冰的物质.下列可用于防冻剂的物质中,含有氮元素的有机物是( )
A.甲醇[CH3OH]
B.氯化钙[CaCl2]
C.尿素[CO(NH2)2]
D.亚硝酸钠[NaNO2]
单质到盐的一种转化关系如图所示,

完全符合图示转化关系正确的是:
A. C、Ca、Na B. S、Cu、Si C. Cl、Fe、Cu D. Na、S、N
由钠、镁、铝、锌四种金属单质中的两种组成的合金共12g,跟足量的![]() 盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是( )
盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是( )
A.Na B.Mg C.Al D.Zn
- 唐以前均规定“工商不得入仕”;唐后期规定工商业者改业三年之后可以入仕;宋代规定“如工商杂类人内有奇才异行、卓然不群者,亦
- 人体甲状旁腺细胞能够摄取氨基酸作为原料合成某种分泌蛋白。下图为人体甲状旁腺细胞示意图,请分析回答:(1)人体甲状旁腺细胞
- “谢太傅寒雪日内集,与儿女讲论文义”这一句总述了谢太傅家人咏雪的背景,极精炼地交代了时间“________”、地点“__
- 划船的事各人在数天以前就早有了准备,分组分帮,各自选出了若干身体结实、手脚伶俐的小伙子,在潭中练习进退。船只的形式,和平
- 森林中的鸟类有垂直分层现象。这种现象主要与下列哪一因素有关 A. 温度 B.食物种类 C
- 肾脏结构和功能的基本单位是( ) A 肾小球 B 肾小囊 C肾小管
- 金属是生产与生活中的重要材料 (1)下列铁制品的用途中,利用金属延展性的是 (填字母)。
- Liu Yang is the first Chinesewoman astronaut_______ has ever
- 对果树进行压条时,需要把压条的树皮环割一圈,环割后剥圈以下的侧芽会迅速发育成侧枝,这是因为( ) A.顶芽不再会
- 如图2-3-16所示,光滑的球半径为10 cm,悬线长L=50 cm,物体B厚20 cm,重12 N,B物体与墙之间的动
- 阅读下文,回答问题。(5分) 农夫耕田 农夫耕于田,数息而后一锄。行者①见而笑曰:“甚矣,农之惰也!数息而后一锄,此田终
- 为保证司乘人员的安全,轿车上设有安全带未系提示系统。当乘客坐在座椅上时,座椅下的开关S1闭合,若未系安全带,则开关S2
- 如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体M和固体N可能是()①稀盐酸和石灰石;②稀硫酸和锌;③水和
- 下列各句中,加点的词语使用恰当的一句是( ) A.储藏谷物的仓库,在稻谷入仓之前,要事先做好清洁工作。 B.与会的代
- 柳宗元在《封建论》中说:“秦有天下,裂都会而为之群邑,废侯卫而为守宰。……此其所以为得也。”这句话指的是
- 如图,在△ABC中,∠C=90°,M是AB的中点,动点P从点A出发,沿AC方向匀速运动到终点C,动点Q从点C出发,沿CB
- 将长势相同、数量相等的甲、乙两个品种的大豆幼苗分别置于两个相同的密闭透明玻璃罩内,在光照、温度等相同且适宜的条件下培养,
- After work I went to the boxoffice to buy the tickets for Ku
- 下列结构属于组织的是( ) A.皮肤 B.肌腱 C.神经纤维 D.唾液腺
- (20分)阅读下列材料 材料一:观察比较右边两幅图 材料二:(明太祖)罢丞相不设,析中书省之政归六部,以尚书任天下事,侍