高中 化学

-
(1) C 中官能团的名称为。
-
(2) 反应③的反应类型为。
-
(3) 反应④的化学方程式为。
-
(4) 实验室由反应④制备 E 可以采用如图所示装置。烧瓶中依次加入 C、浓硫酸、D 和碎瓷片,锥形瓶中加入的是溶液。

 ,下列说法错误的是( )
,下列说法错误的是( ) 


下列说法正确的是( )


 B . 乙炔的结构简式CHCH
C . 乙烯的球棍模型
B . 乙炔的结构简式CHCH
C . 乙烯的球棍模型 
下列说法错误的是( )
 、
、 、
、 、
、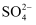 B .
B .  、
、 、
、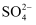 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、 、
、
下图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
① 左边大试管中要加入几片碎瓷片,其作用是
;
②  该装置中使用的玻璃导管较长,其作用是
该装置中使用的玻璃导管较长,其作用是
;
③ 烧杯中还要盛有的物质是 ,
其作用是: 。
向盛有少量 CuCl 2 溶液的试管中滴入少量 NaOH 溶液,再滴入适量浓氨水,下列叙述不正确的是
A .开始生成蓝色沉淀,加入适量浓氨水后,形成无色溶液
B . Cu(OH) 2 溶于浓氨水的离子方程式是: Cu(OH) 2 + 4NH 3 =[Cu(NH 3 ) 4 ] 2 + + 2OH -
C .开始生成蓝色沉淀,加入适量浓氨水后,沉淀溶解形成深蓝色溶液
D .开始生成 Cu(OH) 2 ,之后生成更稳定的配合物
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素 X。它们有如图所示的转化关系(部分产物及反应条件已略去),下列判断正确的是( )

A.X元素不一定为非金属元素 B.单质A可能是Cl2,不能是S
C.反应①和②一定为氧化还原反应 D.反应①和②都为复分解反应
 25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如右图所示。下列说法正确的是( )
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如右图所示。下列说法正确的是( )
A.当pH=2时,溶液中c(ClO-)>c(Na+)
B.当c(ClO-)>c(HClO)时,溶液一定呈碱性
C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应
D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol
·L-1
有一份白色粉末是无水Na2CO3和NaHCO3 的混合物,灼烧至恒重时,质量为21.8g。把放出的气体通入足量澄清石灰水中,生成10.0g沉淀。求原混合物中NaHCO3 的质量分数。
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是:
①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
A.②⑤ B.①③⑤ C.②④⑤ D.④⑤
- 21. 在中国近代史上,有思想家对中国古代社会的评价是:“中国自秦以来二千年,皆专制黑暗政体之历史也。二千年来思想界莫不
- —Do you know _______ woman in red? —Yes, she’s a professo
- 某市中小学统一组织文艺汇演,甲、乙两所学校共92人(其中甲校的人数多于乙校的人数,且甲校的人数不足90人)准备统一购买服
- 2.下列各句中,没有语病的一句是 A. 中车公司研制的全球首列虚拟轨道列车兼具有轨电车和公共汽车的优势,不依赖钢轨行驶,
- 下列有关说法不正确的是 A.在同一种物质中同种元素的化合价可能不相同 B.夏天鱼池内开启增氧泵,是因为温度升高,氧气在水
- 下列属于生物变异现象的是( )A.公鸡和老鹰的羽明显不同 B.一棵树上结的果实,在大小、形态、颜色上有差异 C.蝉的
- 20.阅读下面的材料,根据要求写一篇不少于800字的文章。(50分) 2015年10月4日,青岛市乐凌路“善德活海鲜烧烤
- “今民困国虚,决战之资,唯仰锦耳”,这则材料反映的是三国时期哪国的情况A.蜀国 B.魏国
- 计算: 。
- One man was to meet his wifedowntown and spend some time sho
- 8.下列各组句子中加横线词活用现象不同的一项是( ) A.而后乃今将图南/目吴会于云间 B.眄庭柯以怡颜/策扶老以流
- 某实验小组利用拉力传感器和速度传感器探究“动能定理”.如实图5-3所示,他们将拉力传感器固定在小车上,用不可伸长的细线将
- “微博营销”是一种新兴营销方式,强调以客户为中心,在正确的时间把正确的信息传递给正确的人,它以微博为营销平台,向听众(
- 测得某DNA片段含有碱基1600个,其中腺嘌呤占27.5%,问该DNA复制两次需要游离的鸟嘌呤脱氧核苷酸有多少个(
- 铝土矿是一种用口呵气后会发出强烈土臭味的矿石,主要含Al2O3·H2O、Al2O3·3H2O以及少量Fe2O3、SiO2
- 已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是( ) A. B. C.
- 在平行四边形ABCD中,∠A=,边AB,AD的长分别为2,1.若M,N分别是边BC,CD上的点,且满足=,则·的取值范围
- 阅读下面的古诗,回答问题。(4分)田园乐王维桃红复含宿雨,柳绿更带朝烟。花落家童未扫,莺啼山客犹眠。【小题1】王维的诗“
- 金属钠中的钠原子和氯化钠中的钠离子都属钠元素,原因是( ) A、具有相同的电子数 B、具有相同
- 一切真理只有经历下面三个阶段才会被人接受:第一阶段,觉得可笑而不加理会;第二阶段,视为邪说而强烈抗拒;第三阶段,未加思索



