高中 化学

铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+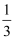 CO(g)═
CO(g)═ Fe3O4(s)+
Fe3O4(s)+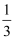 CO2(g)△H2
CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为 (用含△H1、△H2、△H3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为 ,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为 (设其它固体杂质中不含Fe、O元素)。
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)⇌CH4(g)+H2O(g)△H<0.在T℃,106Pa时将1mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断CO(g)+3H2(g)⇌CH4(g)+H2O(g)达到平衡的是 (填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为 ;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为 。
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是 ,理由是 。

 CO2(g)+H2(g)△H<0并建立平衡。下列叙述正确的是( )
CO2(g)+H2(g)△H<0并建立平衡。下列叙述正确的是( )
已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
①H2O2 + I-![]() H2O + IO-慢
H2O + IO-慢
②H2O2 + IO-![]() H2O + O2 + I- 快
H2O + O2 + I- 快
下列说法不正确的是
A. ν(H2O2) =ν(H2O) =ν(O2) B. 反应的速率与I-浓度有关
C. I-是该反应的催化剂 D. 反应①活化能大于反应②的活化能
已知25℃时,H2S的电离常数Ka1、Ka2满足 Ka1·Ka2=3×10-22,H2S饱和溶液物质的量浓度约为0.10mol·L-1;Ksp(CuS)=6×10-36,Ksp(MnS)=4.5×10-14。下列说法正确的是
A.相同温度下,CuS在水中的溶解度比MnS小
B.CuS和MnS一定都溶于强酸
C.反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+ K=7.5×1021
D.在浓度均为0.01mol·L-1Cu2+和Mn2+混合溶液中,通入H2S只有MnS沉淀
⑴磁铁矿的主要成分是 ;
⑵钾云母的化学式是K2H4Al6Si6O24,以氧化物形式可表示为 ;
⑶向FeSO4溶液中滴加NaOH溶液,实验现象是 ;
⑷高温分解碳酸钙,选择合适的坩埚
A.瓷坩埚 B.铁坩埚 C.氧化铝坩埚)
⑸生产玻璃的原料有 、 、石灰石
⑹用于太阳能电池板,进行光电转化的重要半导体材料,其主要成分是 ,
⑺写出一种和氯水漂白原理相同的物质 。
白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物。实验室以白云石为原料制备Mg(OH)2及CaCO3。步骤如下:

实验过程中需要的数据见下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
请回答下列问题:
(1)溶液A中含有Ca2+、Mg2+、Fe2+、Fe3+,则试剂①可选择_________(填字母,下同);试剂②可选择_________;试剂③可选择_________。
(A)KMnO4(B)Cl2(C)MgO(D)CaO
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是_______,然后通入CO2。通入CO2气体应选择的最佳装置为_______(填字母)。

(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为________________________________。
(4)将制取的Mg(OH)2煅烧得到MgO,然后在还原炉(真空)中,1200℃条件下,用硅铁(铁不参与反应)还原生成镁蒸气。在还原过程中反应温度对生成金属镁的影响如下图:

煅烧Mg(OH)2所需要的仪器除三角架、酒精灯外,还必须选择___________。MgO与硅铁发生的反应达到平衡后,平衡常数表达式为_______________________。由图可知,还原反应的△H ____0(填“>”或“<”)。
已知:△G=△H-T△S,△H为焓变,T为热力学温度,△S熵变,当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此,下列叙述中正确的是
A.熵变大于零的反应肯定能自发进行
B.焓变小于零的反应肯定能自发进行
C.焓变大于![]() 零的反应肯定不能自发进行
零的反应肯定不能自发进行
D.焓变小于零且熵变大于零的反应一定能自发进行
 双球洗气管是一种多用途仪器,常用于去除杂质、气体吸收(能防倒吸)、气体干燥等实验。(1)用水吸收下列某气体时,从左方进入的被吸收气体是________。 A.Cl2 B.HCl C.CH4 D.CO2
双球洗气管是一种多用途仪器,常用于去除杂质、气体吸收(能防倒吸)、气体干燥等实验。(1)用水吸收下列某气体时,从左方进入的被吸收气体是________。 A.Cl2 B.HCl C.CH4 D.CO2
(2)若管中盛放的是饱和亚硫酸钠溶液,则可用来吸收的上述气体是______________。(3)简述该仪器可防止倒吸的原因:_______________。
把铁钉和碳棒用导线连起来后浸入食盐水中,可能出现的现象是
A.碳棒上放出氯气 B.碳棒上放出氧气
C.铁钉上放出氢气 D.铁钉逐渐变红色
下列![]() 变化过程中,属于还原反应的是( )
变化过程中,属于还原反应的是( )
A.HCl→Cl2 B.Na→Na+ C.CO→CO2 D.Fe3+→Fe
下表为某有机物与各种试剂的反应现象,则这种有机物是( )
| 试剂 | 钠 | 溴水 | 新制Cu(OH)2悬浊液 | 乙酸 |
| 现象 | 放出气体 | 褪色 |
| 不反应 |
A.CH2=CHCH2OH B.CH2=CHCHO ![]() C.CH2=CHCOOH D.CH3COOH
C.CH2=CHCOOH D.CH3COOH
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
下列离子方程式正确的是( )
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:
NH4+ + Al3+ +2SO42-+ 2Ba2+ + 4OH-===2BaSO4↓+ Al(OH)3↓+ NH3·H2O
B.Na2O2加入H218O中:2Na2O2 + 2H218O===4Na++ 4OH-+ 18O2↑
C.NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-![]() NH3↑ + H2O
NH3↑ + H2O
D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3-+ 6H+![]() Fe3++ 3NO2↑+ 3H2O
Fe3++ 3NO2↑+ 3H2O
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-==Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B. ②③ C. ②④ D. ③④
超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料、经研磨烧结可合成一种高温超导物YBa2Cu3Ox,现欲合成0.5 mol此高温超导物,依化学剂量比例.需取Y2O3、BaCO3和CuO的物质的量分别为
A.0.50,0.50,0.50 B.0.25,1.0,1.5
C.0.50,1.0,1.5 D.1.0,0.25,0.17
在![]() 密闭容器
密闭容器![]() 中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
- 持续的低温大雪使我国北方地区的“暖宝宝”成为紧俏商品。暖宝宝采用铁的“氧化放热”原理,使其发生原电池反应。已知制作暖宝宝
- 曲线的极坐标方程为,则曲线的直角坐标方程为________________。
- 如图,CD是Rt△ABC斜边AB上的高,将△BCD沿CD折叠,B点恰好落在AB的中点E处,则∠A等于() A.25°
- 下列各句中,没有语病的一项是( ) A.《决定》指出,根据战略性新兴产业的特征,立足我国国情,我国现阶段将重点培育
- 某质点从静止开始做匀加速直线运动,已知第3秒内通过的位移是x,则物体运动的加速度为 A.3x/2 B.2x/3 C.
- 与生物体能够由小长大分不开的是( ) A.细胞的生长和分化 B.
- 补写出下列名篇名句中的空缺部分。 (1)对于问题的认识,所处的位置不同,看法也就不同,“当局者迷,旁观者清”就说了这个道
- 物体以v0的初速度从倾角为30°的斜坡底端沿斜坡向上运动。当物体向上滑到某一位置时,其动能减少了ΔEk=12J,机械能减
- 某实验小组采用图所示的装置探究“动能定理”,图中小车可放置砝码。实验中,小车碰到制动装置时,钩码尚未到达地面,打点计时器
- 下列除去杂质的方法中,错误的是( )物质 杂质 除杂质的方法 A.CaCl2溶液 HCl 过量CaCO3、过滤 B
- 阅读下面一首诗,完成下面题目。(共4分)雁门太守行李贺黑云压城城欲摧,甲光向日金鳞开。角声满天秋色里,塞上燕脂凝夜紫。半
- 中国画的艺术创造既具有中国独有的意象建构与表达方式,又蕴含独有的中国智慧与哲理。右图是齐白石的一幅画,画面是两只鸡雏的
- 被誉为世界“第二次绿色革命”的事件发生在 A.20世纪50年代 B.20世纪60年代 C.20世纪70年代
- Great Expectations is one of CharlesDickens’s best-known wor
- 一对表现正常的父母生有一个白化病的孩子,若再生一个孩子的患病的可能性为( ) A.1/2
- 在明代绘画中占统治地位的是 A.宗教画 B.人物画 C.山水
- 下列句子中没有语病的一句是( ) A.在新中国的建设事业上,他们发挥了无穷的力量。 B.我国棉花的生产,长期不
- 下列各句中,加点的成语使用恰当的一项是( )(3分) A.也许有人认为唐代王维除了作诗之外身无长物,其实,王维的
- 2.下列各句中,没有错别字的一项是( ) A.难道我们就这样仰面高卧,紧抱着那虚无缥渺的和平幻觉不放,直到敌人把我
- 2007年4月24日,欧洲科学家宣布在太阳之外发现了一颗可能适合人类居住的类地行星Gliese581c。这颗围绕红矮星G



