高中 化学

A | B | C | D | |
物质的化学式 | 浓H2SO4 | CCl4 | P4 | NH4NO3 |
危险警告标签 | 腐蚀品 | 易燃品 | 剧毒品 | 爆炸品 |
 B . W=
B . W=  C . ρ=
C . ρ=  D . c=
D . c= 
 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、  、
、  ,现取三份100mL该溶液进行如下实验:
,现取三份100mL该溶液进行如下实验: ⑴向第一份溶液中加入AgNO3溶液时有沉淀产生;
⑵向第二份溶液中加入足量NaOH溶液并加热后,收集到气体0.06mol;
⑶向第三份溶液中加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为8.24g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是()
 C . Cl−可能存在
D . Ba2+一定不存在,Mg2+可能存在
C . Cl−可能存在
D . Ba2+一定不存在,Mg2+可能存在

-
(1) 指出在提取碘的过程中有关的实验操作名称:①,③.
-
(2) 提取碘的过程中,可供选择的有机溶剂是(提示:甘油易溶于水,甲苯难溶于水)A . 甲苯、酒精 B . 四氯化碳、苯 C . 汽油、乙酸 D . 汽油、甘油
-
(3) 为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是
-
(4) 从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图2所示实验装置中的错误之处:①;②;③.
-
(5) 进行上述蒸馏操作时,使用水浴的原因是最后晶体碘在中聚集.
-
(1) Na2S2O4用于保鲜剂时能去除O2 , 先生成Na2SO3并缓慢释放SO2 , 该反应的化学方程式为。
-
(2) 锌粉法制备Na2S2O4的工艺流程如图所示:

①实验室可用浓硫酸和亚硫酸钠反应制取SO2 , 并希望能控制反应速度,图中可选用的发生装置是(填字母)。

②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是。步骤Ⅱ中发生反应的化学方程式为。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是。
-
(3) 目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是。
-
(4) 连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32- , [Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02mol•L-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为g•L-1。(以SO2计)
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A.电极b反应式是O2+4e-+2H2O=4OH-
B.电解后乙装置d电极附近溶液的pH不变
C.c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D.甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
.用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.1:3:3 B.1:2:3 C.3:2:2 D.3:1:1
下列叙述中正确的是
A. 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
C. 工业制粗硅2C(s)+SiO2(s)===Si(s)+2CO(g),室温下不能自发进行,则△H>0
D. 稀盐酸和稀氢氧化钠反应的中和热为-57.3 kJ•mol-1,则稀醋酸和稀氨水反应的中和热也为-57.3kJ·mol-1
写出下列反应的离子反应方程式(全对得10分,有错即为0分)
(1)NaAlO2溶液中加入少量的盐酸
(2)AlCl3溶液中加入过量的NaOH
(3)Al2O3与NaOH水溶液的反应
(4)Fe3O4溶解在稀盐酸中
(5)FeCl2溶液中加入酸化的H2O2溶液
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是________________;
制铝时,电解Al2O3而不电解AlCl3的原因是___________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)+Cl2(460 ℃)→SiCl4 SiCl4(纯)+H2(1100 ℃)→Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式: ____________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:______________________________________________________。
已知:C(s)+CO2(g) ![]() 2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
A.升高温度 B.增加碳的质量 C.增大压强 D.加入催化剂
根据你所学知识,判断下列类推结论中正确的是( )
化学事实 类推结论
A 常温下,pH=3的盐酸稀释1000倍后pH=6 常温下,pH=6的盐酸稀释1 000倍后pH=9
B 电解熔融MgCl2可制取金属镁 电解熔融AlCl3也可制取金属铝
C Na着火不能用干冰灭火 K着火也不能用干冰灭火
D 将SO2通入BaCl2溶液中无沉淀生成 将SO2通入Ba(NO3)2溶液中也无沉淀生成
A.A B.B C.C D.D
(1)溶液中的Mn2+可被酸性
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③
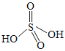 ,则
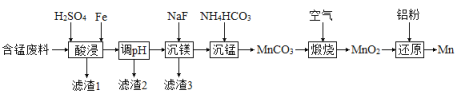
,则(2)实验室用含锰废料(主要成分
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示: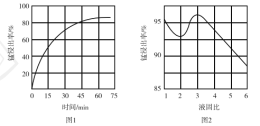
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则“调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。
- In some parts of the world, tea ________ with milk and sugar
- 如图所示,一质量为M的小车停放在光滑水平面上,车上放着一个质量为m的物块,物块与车面的动摩擦因数为μ,现给m一水平向右、
- 三角形两条边长分别为3 cm,5 cm,其夹角的余弦值是方程5x2-7x-6=0的根,则此三角形的面积是
- ______ abroad for years, the old professor returned to the p
- 把△ABC各点的横坐标都乘以-1,纵坐标都乘以-1,符合上述要求的图是( )
- Iwould like to travel by train because I can catch a _____
- 下列生物中属于竞争关系的是A.猫和老鼠 B.蚂蚁和蚱蜢 C.人和猪
- 在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)+Q,下列叙述中,不正确的是: A.矿石
- 唐代的科举制采用了“行卷制”,主考官除详阅试卷外,有权参考举子平日的作品和才誉决定录取结果。宋代的科举制实行“糊名制”,
- 已知集合A={ (x,y)|x,y为实数,且x2+y2=l},B={(x,y) |x,y为实数,且y=x}, 则A ∩
- 下列过程中发生了化学变化的是 A.汽油挥发 B.风力发电 C.铁矿石炼铁 D.太阳能
- 反应N2+3H22NH3刚开始时,N2的浓度为3 mol·L-1,H2的浓度为5 mol·L-1,3 min后测得NH3
- _______ I admit that the problems are difficult , I don’t ag
- 世界上最大的半岛是( ) A. 马来半岛 B.印度半岛 C.朝鲜半岛 D
- 如图4-18所示,3个电解装置中都盛有相同体积和相同物质的量浓度的CuSO4溶液,通电一段时间并且通过相同的电量时,Cu
- 某男学生在体检时被发现是红绿色盲患者,医生在询问家属病史时得悉,该生的母亲既患色盲又患血友病,而父亲性状正常,医生在未对
- --It's burning hot today, isn't it? -- Yes, yesterday
- When Lew Alcindor was 13, and obviously still growing, a
- ---How long do you think the terrible snow will _____? --
- 如图是一张生物概念图,有关分析不正确的是()A.A、B是体液调节和免疫调节,c、d可以是体温和渗透压 B.内环境的稳态只



