高中 化学
光合作用的反应原理为:6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
(1)上述反应中有一种物质属于含有极性键的非极性分子,其电子式为 ,与该分子中心原子同族的短周期元素在周期表中的位置是 .
(2)上述反应涉及的元素中,原子半径由大到小的顺序是 ,原子最外层有两个未成对电子的是
(3)上述反应涉及的元素中,第二周期两种元素的非金属性的强弱关系为 ,试用一个事实说明你的结论
(4)检验C6H12O6可用 (填试剂名称),C6H12O6在人体内被氧化而提供能量,某同学认为该反应和光合作用互为可逆反应,对此,你的观点是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 甲烷与氯气在光照下反应后的混合气体能使湿润的蓝色石蕊试纸变红 | 氯代烷溶于水显酸性 |
| B | 向某卤代烃中加入 | 该卤代烃中含有氯原子 |
| C | 加热乙醇和浓硫酸的混合物,产生能使酸性 | 乙醇发生消去反应生成乙烯 |
| D | 向麦芽糖中加入稀硫酸,一段时间后,加 | 麦芽糖已经水解 |
-
(1) 当日光射入充满气溶胶的暗室时,可观察到效应。
-
(2) 测定某硫酸厂产生的烟气中的SO2 , 可用标准浓度的碘水来测定。测定时使用的指示剂为;发生反应的离子方程式为;实验后发现测定结果偏低,实验操作完全正确的情况下,其原因可能是。
-
(3) 常温下,用NaOH溶液吸收SO2 , 吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
N(SO32-):n(HSO3-)
91:9
1:1
9:91
pH
8.2
7.2
6.2
吸收过程的最开始阶段,水的电离平衡(填“向左”“向右”“不”)移动;请根据表格数据计算亚硫酸的Ka2=。
-
(4) 当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:。
-
(5) 在实验室模拟工业上用NaClO2同时脱硝、脱硫,该过程如下:调节NaClO2吸收液的pH为5,向其中通入含SO2和NO(体积比1:1)的模拟烟气。测得脱硝、脱硫反应后溶液中的阴离子为NO3-、SO42-和Cl- , 其中c(SO42-)=0.88 mol/L,c(Cl-)=0.95 mol/L,已知脱硫效率为89.8%,
请计算脱硝效率为。(结果保留3位有效数字)
 O
B . 氮原子的结构示意图:
O
B . 氮原子的结构示意图:  与CH3CH2CH2CH3
B . 甲烷与乙烷
C . 16O与18O
D . 石墨与金刚石
与CH3CH2CH2CH3
B . 甲烷与乙烷
C . 16O与18O
D . 石墨与金刚石
 2CO(g)+2H2(g) ΔH。回答下列问题:
2CO(g)+2H2(g) ΔH。回答下列问题:
-
(1) 已知:

则ΔH=(用ΔH1和ΔH2表示)。
-
(2) 采用“HSD-2型”催化剂时,该重整反应的速率方程为v正=k·p(CH4)[p(CH4)表示CH4气体分压、k为速率常数],下列说法正确的是____(填标号)。A . 改变催化剂,ΔH不变 B . 升高温度,v正增大 C . 增大CO2的分压时,v正变大 D . 在反应达到平衡时,v正=0
-
(3) 该重整反应的浓度平衡常数的表达式,Kc=,已知,Kc与温度(T)的关系如图,则ΔH0(填“>”、“<”或“=”),判断的理由是。

-
(4) 在T℃、压强为P时,将CH4和CO2按投料比
 加入恒容容器中,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)
加入恒容容器中,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)  CO(g)+H2O(g),则平衡时H2和H2O的物质的量之比为,若温度、压强和投料比一定,为了提高重整反应的速率和H2的选择性,应当。
CO(g)+H2O(g),则平衡时H2和H2O的物质的量之比为,若温度、压强和投料比一定,为了提高重整反应的速率和H2的选择性,应当。
-
(5) 工业上已实现利用H2处理废水中的氮氧化合物,如下图所示。

该电池正极的电极反应式为。

-
(1) 上述资料中的三种常用金属的开发利用之所以有先后,主要取决于 .A . 金属的导电性强弱 B . 金属在地壳中的含量多少 C . 金属的化合价高低 D . 金属的活动性大小
-
(2) 早在西汉成书的《淮南万毕术》里,就有“曾青得铁则化为铜”的记载.曾青又有空青、白青、石胆、胆矾等名称,其实都是天然的硫酸铜.
①写出“曾青得铁则化为铜”的化学方程式.
②若根据上述反应设计成原电池,请在图2方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式.
正极反应:;
负极反应:.


 ;
;  时刻改变某一条件后,根据v(正)、v(逆)的变化情况,可推知改变的条件是增加
时刻改变某一条件后,根据v(正)、v(逆)的变化情况,可推知改变的条件是增加  的量
C . 图丙是某温度下,
的量
C . 图丙是某温度下,  的醋酸与醋酸钠的混合溶液中
的醋酸与醋酸钠的混合溶液中  、
、  与pH的关系,可推知该温度下醋酸的
与pH的关系,可推知该温度下醋酸的  的数量级为
的数量级为  D . 图丁中虚线是
D . 图丁中虚线是  在催化剂存在下反应能量的变化情况,可推知催化剂能降低反应的
在催化剂存在下反应能量的变化情况,可推知催化剂能降低反应的 
 :通过足量灼热的铜粉,收集气体
B .
:通过足量灼热的铜粉,收集气体
B .  :加过量 FeSO4溶液、过滤
C .
:加过量 FeSO4溶液、过滤
C .  :通入饱和
:通入饱和  溶液,洗气
D .
溶液,洗气
D .  :通入氧气点燃
:通入氧气点燃
下列所发生的化学反应和实验室用乙醇和浓硫酸制乙烯的化学反应类型相同的是
A.乙稀能使溴水褪色 B.溴乙烷在NaOH的乙醇溶液中的反应
C.用乙酸和乙醇在浓硫酸作用下制乙酸乙酿 D.乙醛能将新制的Cu(OH)2还原成Cu2O
在下列结构中,核磁共振氢谱中出现三组峰的化合物是

实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

下列叙述不正确的是
A.“操作X”的名称为萃取,可在分液漏斗中进行
B.“还原”步骤发生的反应为:![]()
C.“氧化”过程中,可用双氧水替代氯气
D.“富集”即I2富集于有机溶剂,同时除去某些杂质离子
阅读材料,回答问题:
(1)某无色液体A,通电时生成无色气体B和C,B能使带火星的木条着火,C能在空气中燃烧,发出淡蓝色火焰且只生成A.则B、C的化学式分别为 、2 ;
(2)若已知1mol气体C燃烧后生成A液体时放出285.8kJ的热量,试写出其燃烧的热化学方程式. ;
(3)能源可分为一级能源和二级能源.自然界以现存形式提供的能源称为一级能源;需要依靠其他能源的能量间接制取的能源称为二级能源.那么,气体C是 级能源,你认为气体C作为能源的最突出的优点是 .
下列实验描述错误的是( )
A. 实验室用无水乙醇加热至170 ℃,可制得乙烯
B. 只用新制氢氧化铜悬浊液(可以加热)可将乙醇、乙醛、乙酸三种液体区别出来
C. 用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
D. 将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,不能用来检验溴乙烷中溴元素的存在
.科技文献中经常出现的下列词汇,其中与相关物质的颜色并无联系的是( )
A.赤色海潮 B.棕色烟气 C.白色污染 D.绿色食品
下列有关有机物结构和性质的说法错误的是
A. 分子式为C5H10O2且能与 NaHCO3反应放出气体的结构共有4种
B. 石油是混合物,可通过分馏得到汽油、煤油等纯净物
C. 苯甲酸(![]() )分子中所有原子可能位于同一平面
)分子中所有原子可能位于同一平面
D. 1mol盐酸美西律( )最多可与3 mol H2发生加成
)最多可与3 mol H2发生加成
常温下,将一定量的钠铝合金置于水中,合金全部溶解,所得的溶液中仍含有0.02mol的NaOH ,然后向溶液中逐滴加入lmol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
A. 原合金质量为0.92g B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL D. 图中m的值为1.56g
乙醇分子中不同的化学键如图关于乙醇在各自种不同反应中断裂键的说明不正确的是( )

A、和金属钠反应,键①断裂
B.在Cu催化下和O2反应,键①③断裂
C.和乙酸发生酯化反反应时,键②断裂
D.和浓硫酸共热170℃时,键②⑤断裂
- 第二节 信息匹配(共5小题;每小题2分,满分10分) 阅读下列应用文及相关信息,并按照要求匹配信息。请在答题卡上将对应
- 下列4支试管中分别含有不同的化学物质和活性酵母菌细胞制备物。经过一定时间的保温后,会产生CO2的试管是
- 如图,AB为⊙O直径,CD为⊙O的弦,∠ACD=25°,∠BAD的度数为.
- ∀x,y,z∈(0,+∞),,则m的取值范围为 A. B.(-∞,3] C.(-∞,2] D.
- 2008年5月12日,汶川发生特大地震。据相关知识回答下题。 震灾无情人有情,一方有难八方援。地震发生后,从个人到团体都
- 现代史学家陈寅恪认为:韩愈不仅“结束南北朝相承之旧局面”,而且“开启赵宋以降之新局面”,是“唐代文化学术史上承前启后、转
- 下列各句中加点的熟语,使用不恰当的一句是 A.曲歌更是个平实的人,虽然在工作中她取得了不小的成绩,可以说在江西是
- 李白的《宣州谢朓楼饯别校书叔云》中,以水喻愁,表明愁绪无法排解的诗句是:“ ,
- 如图,某森林公园有一直角梯形区域ABCD,其四条边均为道路,AD∥BC,∠ADC=90°,AB=5千米,BC=8千米,C
- 如图所示,红蜡块可以在竖直玻璃管内的水中匀速上升,若在红蜡块从A点开始匀速上升的同时,玻璃管从AB位置水平向右做匀速直线
- 在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀 切开观察。在这一实验过程中不能得出的钠的物理
- 如图所示,用轻绳系住一小球静止在光滑斜面上。若要按力的实际作用效果来分解小球的重力G,则G的两个分力的方向分别是图中的
- 据图判断,下列叙述符合生态学原理的是 A.物质经过多级利用,实现了
- 下列词语中字形及加点字的释义完全正确的一项是( ) A.告罄:尽、空/走头无路:尽头/心无旁骛:追求 B.喧嚣:吵闹
- 如果反比例函数y的图象在第二、四象限,那么k的取值范围是____▲___.
- 世界平均人口密度是47人/平方千米,中国是世界的3倍多,那中国是( ) A.124人 B
- 漫画《没水》给我们的哲学启示是 A.实践是认识的来源 B.深入实际,才能真正使主观与客观相符合 C.发挥主观
- 基因型为AaBbCcDd和AABbCcDd的向日葵杂交,按自由组合定律,后代中基因为AABBCcdd的个体所占的比例为A
- 我寄愁心与明月, 。(李白《闻王昌龄左迁龙标遥有此寄》)
- 阅读下面一首古诗,回答下面问题。晚 春韩愈草木知春不久归,百般红紫斗芳菲。杨花榆荚无才思,惟解漫天作飞雪。本诗运用拟人手
 溶液,加热一段时间后冷却;加入足量稀硝酸酸化,再滴加
溶液,加热一段时间后冷却;加入足量稀硝酸酸化,再滴加 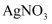 溶液,产生白色沉淀
溶液,产生白色沉淀 溶液褪色的气体
溶液褪色的气体


