高中 化学

 C . 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D . 反应至15min时,改变的反应条件是降低温度
C . 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D . 反应至15min时,改变的反应条件是降低温度
 +6H2O。则下列有关说法错误的是( )
+6H2O。则下列有关说法错误的是( )
 +6H2O
D . 每转移0.6 mol电子,则消耗氧气的体积为3.36L
+6H2O
D . 每转移0.6 mol电子,则消耗氧气的体积为3.36L
A.A(g)+B(g)=C(g)△H1<0 A(g)+B(g)=C(l)△H2<0 则△H1△H2
B.S(g)+O2(g)=SO2(g)△H1<0 S (s)+O2(g)=SO2(g)△H2<0 则△H1△H2
C.C(s)+O2(g)=CO2(g)△H1<0 C(s)+ 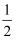 O2(g)=CO(g)△H2<0 则△H1△H2 .
O2(g)=CO(g)△H2<0 则△H1△H2 .
-
(1) NaCl溶液加热蒸干后最终产物是
-
(2) NaHCO3溶液加热蒸干灼烧后最终产物是
-
(3) AlCl3溶液加热蒸干灼烧后最终产物是
-
(4) Na2SO3溶液加热蒸干灼烧后最终产物是.
选项 | A | B | C | D |
生活中的物质 | 食盐 | 熟石灰 | 复方氢氧化铝片 | 酒精 |
有效成分的化学式 | NaCl | CaO | Al(OH)3 | C2H5OH |
用途 | 做调味品 | 干燥剂 | 做抗酸药 | 消毒 |
-
(1) 在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为; Fe2+在酸性条件下被O2氧化的离子方程式为。

-
(2) 盐基度[B=
 × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响。(填“越大”、“越小”或“无影响”)
-
(3) PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL−1 , 样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L−1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L−1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)。
已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论正确的是
A.氯化铝硬度大,固体可导电
B.氯化铝易溶于有机溶剂,难溶于水
C.氯化铝中存在离子键
D.氯化铝属于分子晶体
下列变化中,不存在化学键断裂的是
A . 氯化氢气体溶于水 B . 干冰升华
C . 氯化钠固体溶于水 D . 氢气在氧气中燃烧
常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
① pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: ;
② 0.2 mol·L-1 HA溶液与0.1mol·L-1 NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)-c(OH-)= mol·L-1。(溶液体积变化忽略不计)
A是一种重要的化工原料,A的产量通常用衡量一个国家石油化工发展水平标志。E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

(1)工业上,由石油获得石蜡油的方法是 ;
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式是: ;
(3)A→B的化学方程式是: 该反应的反应类型是 ;
(4)B→C的化学方程式为: 该反应的反应类型是 ;
(5)反应B+D→E的反应的速率比较缓慢,我们在实验中为了提高该反应的速率,通常采取的措施有: 。
某金属A及其化合物之间有如下的
 转化关系:
转化关系:
(1)写出下列物质的化学式:
A ;D
(2)向B溶液中加入KSCN溶液现象
再加入A振荡后现象
(3)写出E生成C的化学方程式
已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )

A.0~b间反应:3HSO3﹣+IO3﹣=3SO42﹣+I﹣+3H+
B.a点时消耗NaHSO3的物质的量为1.2 mol
C.b~c间反应:I2仅是氧化产物
D.c点之后碘的物质的量不变是因为还原剂消耗完全
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(5)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为 3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;
下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
A. NaOH的碱性比Mg(OH)2的强
B. Cl2得到电子的能力比Br2的弱
C. 原子半径r: ![]()
D. 原子的最外层电子数n: ![]()
今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 ▲ 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg ▲ Al | O ▲ S | MgO ▲ MgS | H2O ▲ H2S |
(3)基态铬原子外围电子轨道表示式为 ▲ 。
反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑤ D.③⑤⑥
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列
 叙述正确的是( )
叙述正确的是( )
A.迷迭香酸属于芳香烃
B.1mol迷迭香酸最多能和9mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
.物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为( )
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.3∶4∶3
向某碳酸钠溶液中逐滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO![]() 的物质的量随加入盐酸体积的关系如图所示,其中n2∶n1=3∶2,则下列说法中正确的是
的物质的量随加入盐酸体积的关系如图所示,其中n2∶n1=3∶2,则下列说法中正确的是
A.b点的数值为0.6
B.该碳酸钠溶液中含有1 mol Na2CO3
C.b点时生成CO2的物质的量为0.3 mol
D.oa段反应的离子方程式与ab段反应的离子方程式相同
A. 浓硫酸具有脱水性,可用于干燥氯气
B. 晶体硅熔点高,可用于制作半导体材料
C. Na2CO3溶液显碱性,可用热的纯碱溶液洗油污
D. FeS固体呈黑色,可用于除去废水中Cu2+、Hg2+等重金属
- 下列有关细胞膜的信息交流的说法,正确的是() ①不同细胞之间必须相互接触才能传递信息 ②能在细胞之间传递信息的物质都是激
- 下列生物中属于原核生物的一组是() ①蓝藻 ②酵母菌 ③草履虫 ④念珠藻 ⑤水绵 ⑥青霉菌 ⑦葡萄
- 16世纪初,当一名航海家宣布将要远航的消息之后,“大约有一万个‘没有工作’的贵族愿意不领取任何报酬与他一起出海航行”。欧
- 自去年3月份开始,一场突如其来的流感疫情开始在我国某些地区发生,并迅速蔓延家,经专家研究确定, 引起该疫情的是甲型H7N
- 如图B-5所示,“U”形导轨宽L,与水平面夹角为α,垂直于导轨平面向上的匀强磁场的磁感应强度为B.一根质量为m、长也是L
- 如果你家里的食用花生油混有水份,你将采用下列何种方法分离 ( ) A.过滤 B.蒸馏
- — Tomorrow ____ my birthday. I’d like you and Jane to come?
- 民主是指在一定阶级范围内,按照平等的原则和少数服从多数的原则来共同管理国家事务的国家制度。这里的“按照平等的原则和少数服
- (1)向容积为250 mL的细颈玻璃仪器A中加水至虚线处,再滴几滴红墨水,一段时间后,A中的现象是___________
- 综合性学习(4分) 每个人心中都有自己的“星”,这些“星”可能是伟人﹑专家、学者……也可能是影视名星、流行歌星、体育明星
- 根据我国经济社会发展的新情况,国务院做出自2007年8月15日起,对储蓄存款利息所得个人所得税的适用税率由20%调减为5
- 从方框中选择正确选项填入空格。(每小题1分,共5分)John: Hi, Mike. Where is your fami
- 阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是 ( )A.1 mol H2O2完全分解时转移
- 公元前四世纪,毕达哥拉斯学派对数和形的关系进行了研究.他们借助几何图形(或格点)来表示数,称为形数.形数是联系算数和几何
- 下列关于生物技术的安全性和伦理问题的分析,不合理的观点是() A.运用重组基因技术可以将致病菌或病毒改造成威力巨大的生物
- (2008年黄冈模拟)给绿色植物施加含15N的氮肥,羊吃了绿色植物后,在尿液中检测出15N。下列有关15N的转移途径,不
- 下列词语中加点字注释全都正确的一项是 A.秀颀(高) 再接再厉(厉害) 因地制宜(根据) B.
- 根据你所了解的生物分类方法,你认为下列哪一组归类是正确的? ( ) A.蟹、蟋蟀、西瓜为陆生生物 B.鸡、猪、鸭为家禽
- 根据所给提示,完成句子,每空一词,含缩略词。 1. Most people watched TV late in May
- 鉴别物质是学习化学常用的方法之一。下列实验设计不能达到实验目的是()实验目的 实验设计 A 鉴别空气、氧气、二氧化碳 燃



