高中 化学

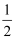 apm
apm

已知:H2S的电离常数K1=1.3×10-7 , K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6
回答下列问题:
-
(1) 合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,还原产物为N2 , 金属镍溶解的离子方程式是;“酸溶”时产生的废渣主要成分为。
-
(2) “除铁”加入Na2CO3时,生成黄钠铁矾(NaFe3(SO4)2(OH)6)的离子方程式是;“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾沉淀对后续操作较为有利,原因是。
-
(3) “除铜”时,反应的离子方程式为H2S+Cu2+=CuS↓+2H+ , 该反应平衡常数K=。
-
(4) “除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是。
-
(5) “沉镍”前c(Ni2+)=1.0mol/L,加入少量浓NaOH溶液,若忽略加入浓NaOH溶液对溶液体积的影响,则开始沉淀时溶液的pH=。
-
(6) 用含镍21%的100kg铁镍合金废料经上述工艺制得31kgNi(OH)2固体,镍的回收率为。
| 选项 | 被提纯物质 | 杂质 | 除杂试剂或方法 |
| A | FeCl3溶液 | FeCl2 | 通入适量Cl2 |
| B | FeCl2溶液 | FeCl3 | 加入过量铁粉并过滤 |
| C | 铜粉 | 铁粉 | 加入过量盐酸并过滤 |
| D | Fe(OH)3 | Fe(OH)2 | 在空气中灼烧 |
 价,Y元素与Z、M元素相邻,且与M元素同主族;化合物
价,Y元素与Z、M元素相邻,且与M元素同主族;化合物  的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )
的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )
 B . 最高价氧化物对应水化物的酸性:
B . 最高价氧化物对应水化物的酸性:  C .
C .  易溶于水,其水溶液呈碱性
D . X、Z和Q三种元素形成的化合物一定是共价化合物
易溶于水,其水溶液呈碱性
D . X、Z和Q三种元素形成的化合物一定是共价化合物
(1)有机物分子式.
(2)已知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式.
 KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量比为( )
KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量比为( )
 混合加热并达到平衡:
混合加热并达到平衡: K=0.1。反应前CO物质的量为5mol,达到平衡时CO的物质的量为4mol。下列说法正确的是( )
K=0.1。反应前CO物质的量为5mol,达到平衡时CO的物质的量为4mol。下列说法正确的是( )
 浓度增加,表明该反应是吸热反应
B . 分离出羰基硫后,逆反应速率逐渐减小
C . 反应前
浓度增加,表明该反应是吸热反应
B . 分离出羰基硫后,逆反应速率逐渐减小
C . 反应前 物质的量为3.5mol
D . CO的平衡转化率为80%
物质的量为3.5mol
D . CO的平衡转化率为80%
 Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如![]() 下图:
下图:
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件![]() 下,反应达平衡时,c(H2O)=_____________mol/L。
下,反应达平衡时,c(H2O)=_____________mol/L。
![]() Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(![]() AgCl)=1.8×10-10,
AgCl)=1.8×10-10,
Ksp(AgI)=8.5×10-17。
“纳米材料”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是 ( )
A.能全部透过半透膜 B.有丁达尔效应
C.所得液体一定能导电 D.所得物质一定为悬浊液或乳浊液
下列图像分别表示有关反应的反应过程与能量变化的关系

据此判断下列说法中正确的是( )
A . 石墨转变为金刚石是吸热反应
B . 白磷比红磷稳定
C . ① S(g)+O 2 (g)=SO 2 (g); ② S(s)+O 2 (g)=SO 2 (g) ;放出热量: ① ˂ ②
D . CO(g)+H 2 O(g)=CO 2 (g)+ H 2 (g) ;该反应为吸热反应
无水NaBr的制备流程如图:

己知:
①3Br2+6NaOH=5NaBr+NaBrO3+3H2O;
②Br2溶于NaBr溶液生成NaBr3,离子方程式可表示为Br2+Br-⇌Br3-。
请回答:
(1)“反应I”所用NaOH溶液最好是饱和溶液,理由是______
(2)已知“热还原”反应中,氧化剂和还原剂物质的量之比为1:3,若该反应中消 耗了12g碳粉,则理论上最终可制得NaBr的质量为______(不考虑制备过程中的损失)。
(3)“脱色”过程中生成了两种强酸,写出该过程的离子方程式:______
(4)用FeBr3与Na2CO3溶液反应是制备NaBr的另一种方法,反应过程中有气体和 沉淀生成,写出此方法的化学方程式:______
某同学通过系列实验探究 Fe 及其化合物的性质,操作正确且能达到目的的是
A . 将 0.1 mol/L 的 FeCl 3 溶液与 0.3mol/L 的 NaOH 溶液等体积混合制备 Fe(OH) 3 胶体
B . 将 FeSO 4 溶液缓慢滴入足量 NaOH 溶液,过滤、洗涤、干燥获得纯净的 Fe(OH) 2 固体
C . 铁粉中混有铝粉,加入过量 NaOH 溶液充分反应后过滤
D . 可用带火星的木条检验铁与水蒸气反应后的气体产物,木条复燃
提供能量主要来源的一组营养要素(A)
A、糖类、油脂、蛋白质 B、水、无机盐、维生素
C、油脂、维生素、无机盐 D、水、蛋白质、糖类
下列变化可通过一步化学反应实现的是
A.Na2O2→Na B.Al2O3→Al(OH)3
C.SiO2→H2SiO3 D.Na2CO3→NaOH
如表中物质分类完全正确的是 ( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水玻璃 | 硫酸 | 干冰 |
| B | 小苏打 | 漂粉精 | 铁 | 氨气 |
| C | 液氨 | 碱石灰 | 氢氧化钠 | 二氧化碳 |
| D | 硝酸 | 食盐水 | 氯化铜 | 氯气 |
- 如图17-2-3所示,电路中所有元件完好,但光照射到光电管上,灵敏电流计中没有电流通过,其原因可能是( ) 图17
- 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01
- Gary, please do me a favor--- _____ my laptop for me.A. to f
- 地球自转的真正周期是: A、1恒星日——23小时56分4秒 B、1太阳日——24小时 C、1恒星年——365日6时
- 读“地球上的五带示意图”,完成下列要求:(10分)(1)写出图中字母表示的温度带的名称。 A. B.
- 阅读下面的文言文,完成下列各题 阅江楼记 明·宋濂 金陵为帝王之州。自六朝迄于南唐,类皆偏据一方,无以应山川之王
- 下列变化属于物理变化的是( )A.火箭发射 B.节日焰火 C.风力发电 D
- 甲、乙两物体先后从同一地点出发,沿一条直线运动,它们的v-t图象如图所示,由图可知() A.甲比乙运动快,且早出发,所以
- The moment Hans finishedhis driving test perfectly, he got
- 目前,我国农村普遍建立了实施民主决策的村民会议或村民代表会议制度,制定了村民自治章程或村规民约,建立了民主理财、财务审计
- 在中,若则的形状是
- 据某校调查,该校学生平时与长辈说话态度生硬的占69.7%;很少做家务的占70.2%;课余时间,有60.4%的学生选择和同
- 针对以下四幅图,下列说法正确的是 :
- Agnes Miller was one of the earliest leaders of the Women’s
- 如图是人体的反射弧结构图,请据图回答:(1)完成缩手反射的一个反射弧需要几个神经结构的参与 . (2
- 天体系统的层次,由小到大排列顺序正确的是 A.太阳系→银河系→地月
- 中共中央办公厅、国务院办公厅转发《关于领导干部定期接待群众来访的意见》要求,要把领导干部接访的重点定位在“事要解决”上,
- . The computer is fast, and never makes a mistake, while peo
- (1)利用所学化学知识回答下列问题.①碘酒是家庭常备药,碘酒中的溶剂是 _________ (写名称)②炎热的夏季,自行
- “亚东开发中华早,揖美追欧,旧邦新造。飘扬五色旗,民国荣光,锦绣山河普照。我同胞,鼓舞文明,世界和平永保。”这段歌词创



