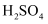高中 化学
① I2 + SO2 + 2H2O = H2SO4 + 2HI;
② 2FeCl2 + Cl2 = 2FeCl3;
③ 2FeCl3 + 2HI = 2FeCl2 + 2HCl +I2
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):

-
(1) 写出生成白色沉淀B的离子方程式:.
-
(2) 若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子
Cl﹣
Br﹣
CO32﹣
HCO3﹣
SO32﹣
SO42﹣
浓度/mol•L﹣1
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:.
-
(3) 若无色气体D是混合气体,待测液中一定含有的阴离子是.
已知:2CH3CHO  CH2CH(OH)CH2CHO
CH2CH(OH)CH2CHO  CH2CH=CHCHO
CH2CH=CHCHO

-
(1) 写出X的结构式
-
(2) 对于高分子化合物C的说法正确的是 . (填序号)A . 1molC能与2n molNaOH反应 B . (C9H8O3)n既是高分子化合物C的化学式,也是链节的化学式 C . 高分子化合物C是缩聚产物 D . 酸性条件下降解时有气泡产生
-
(3) 在一定条件下,E可以生成一种含有3个六元环的化合物(C18H16O4),请写出该反应的化学方程式
-
(4) 写出符合要求的G的同分异构体(含有
 的有机物不能稳定存在)
的有机物不能稳定存在) a.遇FeCl3溶液显紫色b.能与Br2按1:2发生加成反应 c.苯环上只有两种等效氢
-
(5) 根据题目所给信息,以F和乙烯为原料,设计合成G的反应路线(用流程图表示,无机试剂任选).
例:CH3CH2OH
 H2C=CH
H2C=CH 

 D .
D . 
-
(1) 气态氢化物热稳定性
 大于
大于  的主要原因是。
的主要原因是。
-
(2)
 是离子化合物,各原子均满足8电子稳定结构,
是离子化合物,各原子均满足8电子稳定结构,  的电子式是。
的电子式是。
-
(3) 常温下,在水中的溶解度乙醇大于氯乙烷,原因是。
 Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
 ,下列各组实验中最先出现浑浊的是( )
,下列各组实验中最先出现浑浊的是( ) | 实验 | 反应温度 | | 稀 | | ||
| | | | | | ||
| A | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| B | 25 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
一切化学反应除了有质量的变化外,还伴随着 的变化,它们分别遵循 定律和 定律。能量变化通常主要表现为
的变化,即 或者 。
一常见碳氢化合物A,不使溴水褪色.0.5摩尔A完全燃烧时,得到1.5摩尔水和67.2二氧化碳(标准状况).
(1)通过计算,判断A是什么物质?
(2)根据下列条件,写出有关化学方程式(有机物用结构简式):
(a)在催化剂FeCl3的作用下,A与氯气反应生成B.
(b)用铜作催化剂在高温加压下,B在碱溶液里水解制得C.
(c)在催化剂作用下, C与甲醛反应,得到一种高聚物.
在0.1 mol・L-1的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
B.c(Na+)> c(CO32-)> c(OH-)> c(HCO3-)> c(H+)
C.c(Na+)+ c(H+)= c(OH-)+c(CO32-)+ c(HCO3-)
D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)
可检查淀粉部分发生水解的试剂是( )
A. 碘水 B. 碘化钾溶液
C 硝酸银溶液 D. 银氨溶液、碘水
下列离子方程式正确的是
![]() A.
A.![]() 与
与![]() 溶液反应:
溶液反应: ![]()
![]() B.
B.![]() 溶液吸收
溶液吸收![]() 气体:
气体: ![]()
![]() C.
C.![]() 溶液中加入过量的浓氨水:
溶液中加入过量的浓氨水: ![]()
![]() D.等体积、等浓度的
D.等体积、等浓度的![]() 稀溶液与
稀溶液与![]() 稀溶液混合:
稀溶液混合:
![]()
![]()
![]()
![]()
关于生铁和钢的描述正确的是 ( )
A.生铁和钢的主要成分都是铁,性能相近
B.生铁和钢是含碳量不同的两种铁碳的合金
C.钢的性能不如生铁优越,使用范围不如生铁广
D.生铁是铁碳混合物,钢是纯铁是纯净物
下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的元素的原子最外层电子数之和为20。则下列说法正确的是( )
| X | Y | ||||
| W | Z |
A. 氢化物的沸点:Y<Z
B. 原子半径大小:Z>W>Y>X
C. 工业上用电解熔融的W与Y所形成的化合物来制取W
D. X的一种氢化物可以和Z的单质反应生成大量白烟
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

提示: ①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称是 、 、过滤。
(2)试剂a的名称是 。
(3)用氯化镁电解生产金属镁的化学方程式为: 。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是 。
- 江苏省人民政府2011年《政府工作报告》提出:全力打好节能减排攻坚战,积极推进重点节能工程和减排重点项目。打好节能减排攻
- 下列各句中,加点的成语使用不恰当的一句是( )A.近年来,在各地蓬勃兴起的旅游热中,以参观革命圣地、踏访英雄足迹为
- 与我国隔海相望的国家是( ) A.俄罗斯 B.缅甸 C.文莱 D.吉尔吉斯斯坦
- 天宫一号(Tiangong﹣1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心成功发
- The activists insisted that their leader of their fight for
- 关于下列生活经验和化学知识的叙述中,正确的是( ) A.人体不可缺铁,缺铁赶快补铁单质 B.人们为了提高
- Tim Welford, aged 33, and Dom Mee, aged 30, both from Englan
- 如题21图所式,矩形MNPQ区域内有方向垂直于纸面的匀强磁场,有5个带点粒子从图中箭头所示位置垂直于磁场边界进入磁场,在
- (4分)实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题(1)制过程中需要使用的主要玻璃仪器包括烧
- 如图所示,在竖直平面内,光滑绝缘直杆AC与半径为R的圆周交于B、C两点,在圆心处有一固定的正点电荷,B点为AC的中点,C
- 已知3x3y2与﹣2x3my2是同类项,则4m﹣24的值是() A. 20 B. ﹣20 C. 28 D. ﹣28
- 下列各句中加点的词语,使用不恰当的一句是 A.第五届两岸信息技术论坛闭幕,两岸业界人士共同表示,要抓住两岸关系呈现和平发
- After he became conscious,he remembered and on
- 在同一时空下,生产同样的商品,不同的生产者有的赚钱有的赔本,其根本原因在于A.生产技术条件不同
- 下列各组长度的线段中,成比例线段的是A.1cm,2cm, 3cm, 4cmB.1cm, cm, cm,cmC.2cm,
- 9.右图是《万里茶路》示意图,一条弥漫着茶香的曲线从中国福建的武夷山脉伸向俄罗斯的恰克图。这便是由中国晋商开辟的绵延清代
- 在下面两种怦境下,用语最得体的一组是 [情境1]某同学的发言超时了,你作为主持人,需要终止他的发言。 [情境2]革同学正
- - Would youmind ____ down the music? It’s too noisy. -_
- 一个登月的宇航员,能否用一个弹簧秤和一个质量为m的砝码,估计测出月球的质量和密度?如果能,说明估测方法并写出表达式.设月
- 随着我国改革开放的日益深化,成为国际经济、金融和贸易中心之一的是( )A .海南经济特区B .上海浦东开发区C .环渤海

 溶液
溶液