高中 化学
锌片:Zn+2OH--2e-=ZnO+H2O;
碳棒:O2+H2O+2e-=2OH- ,
据此判断,锌片是( )

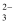 、Cl−、NO
、Cl−、NO  、Na+
B . 在能使酚酞变红的溶液中:Na+、Cl−、NO
、Na+
B . 在能使酚酞变红的溶液中:Na+、Cl−、NO  、K+
C . 在1 mol·L-1的NaAlO2溶液中:K+、Ba2+、SO
、K+
C . 在1 mol·L-1的NaAlO2溶液中:K+、Ba2+、SO  、OH−
D . 在1 mol·L-1的AlCl3溶液中:NH
、OH−
D . 在1 mol·L-1的AlCl3溶液中:NH  、Ag+、Na+、NO
、Ag+、Na+、NO 
-
(1) 燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g)
 CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H①已知:
化学键
C-H
C-O
C=O
H-H
O-H
键能/KJ/mol
412
351
745
436
462
则△H =
-
(2) 在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: 时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
①到达平衡时NO的转化率为。
②用O2表示从0~2 s内该反应的平均速率v=。
③如下图所示,表示NO2变化曲线的是。

④能说明该反应已达到平衡状态的是(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
-
(3) 某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示

该反应的的化学方程式为。


-
(1) 装置A中制取Cl2的化学方程式为。
-
(2) 装置C中发生反应的离子方程式为,反应后溶液中含Cl元素的分子有。
-
(3) 实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 。
-
(4) 装置F的作用是,该装置中发生反应的离子方程式。
 下,
下,  、
、  、
、  和
和  的燃烧热ΔH依次是
的燃烧热ΔH依次是  、
、  、
、  、
、  ,下列热化学方程式书写正确的是( )
,下列热化学方程式书写正确的是( )
 ΔH=-566kJ/mol
B .
ΔH=-566kJ/mol
B .  ΔH=-1411kJ/mol
C .
ΔH=-1411kJ/mol
C .  ΔH=-3267.5kJ/mol
D .
ΔH=-3267.5kJ/mol
D .  ΔH=-1366.8kJ
ΔH=-1366.8kJ

-
(1) A的名称为,B中所含官能团名称为,实验室模拟进行反应⑤的条件为。
-
(2) 写出反应②的化学方程式:,该反应类型为。
-
(3) 下列说法正确的是____。A . 反应②与④类型相同 B . 物质B可用作燃料,其属于不可再生资源 C . 物质D可与碳酸氢钠溶液反应 D . E在一定条件下能与HCl发生加成反应,只能得到一种产物
-
(4) 久置的丙烯酸乙酯自身会发生加聚反应,所得聚合物具有较好的弹性,可用于生产织物和作皮革处理剂,聚丙烯酸乙酯的结构简式为。
含有泥沙的江河水(泥沙胶粒带负电荷)用作工业用水时,必须经过净化,用明矾可作净水剂,
明矾除去江河水中泥沙的主要原因是 ( )
A.明矾与泥沙发生了化学反应 B.明矾溶液中的胶粒具有很强的吸附作用
C.明矾溶液中的胶粒与泥沙胶粒所带的电荷电性相反D.明矾溶液中的胶粒与泥沙碰撞而沉淀
已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能I(kJ·mol-1)如下表所示:
| I | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
(1)三种元素的电负性大小关系为____________。
(2)写出Y原子的核外电子排布式____________,Y的第一电离能大于Z的第一电离能的原因为____________________________________________________。
(3)X晶体的堆积方式为________(填字母序号)。

(4)NaCl、KCl、MgO、CaO晶体结构相似,其中四种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO | MgO |
| 晶格能(kJ·mol-1) | 787 | 715 | 3401 | 3890 |
4种晶体的熔点由高到低的顺序是____________________________。
下列说法正确的是( )
A. 非自发进行的反应一定不能发生
B. 自发进行的反应一定能迅速发生
C. 在一定条件下,非自发进行的反应也能发生
D. 吸热反应一定不能自发进行
小康同学用一定量的Na2O2与水反应,制取中学一种常见气体。
(1)相关反应的化学方程式是__________________________________,检验反应生成气体的方法是 。
(2)利用本实验所得到的溶液(经检测为400 mL 1.0 mol/ L的碱溶液),小康又进行了两个自己感兴趣的实验。
①取100 mL 该溶液用于氯气的尾气吸收,则最多可吸收标准状况下的氯气多少升?(请写出相关反应的方程式或关系式,并列式计算,下同)
②取100 mL 该溶液恰好能与10 g某镁铝合金恰好完全反应,请计算该合金中铝的质量分数。
有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8g该有机物经燃烧生成44.0g CO2和14.4g水.质谱图表明其相对分子质量为84;红外光谱分析表明A中含有﹣O﹣H和位于分子端的CCH,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1.
(1)写出A的分子式 ;
(2)写出A的结构简式
(3)下列物质一定能与A发生反应的是 (填序号)
a.H2 b.Na c.KMnO4 d.Br2
(4)有机物B是A的同分异构体,1mol B可以与1mol Br2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1,则B的结构简式是
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A、 NA的单位是摩尔
B、 12g12C 中所含的碳原子数为NA
C、 标况下22.4L的任何气体所含原子数为NA个
D、 相同体积的O2(g)和NO2(g)分子数均为NA
在一定条件下,Na2S溶液存在水解平衡:S2−+H2O![]() HS−+OH−。下列说法正确的是( )
HS−+OH−。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.升高温度,c(HS−)/c(S2−)增大
C.加入NaOH固体,溶液pH减小
D.通入CuSO4固体,HS−浓度增大
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
| A | A原子核外电子有6种不同的运动状态 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | D原子最外层电子数等于电子层数 |
| E | E的基态原子最外层电子排布式为3s23p2 |
| F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是_________________________________________________
(2)A、B、E三种元素电负性由大到小排列顺序为________________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为____________________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式____________________________________________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度__________________________g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式__________________________________________________________________________
(8)某学生所做的有关F元素的实验流程如下图:
F单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:_________________________________________________________
- 如图9所示,通过水平绝缘传送带输送完全相同的铜线圈,线圈均与传送带以相同的速度匀速运动.为了检测出个别未闭合的不合格线圈
- ;
- 1954年北京著名的中药老店同仁堂的经理乐坛生带头响应政府号召,主动接受资本主义工商业的改造。政府对同仁堂的改造方式是
- “事件发生的第二天,奥匈帝国外长就叫嚣:‘到了该解决塞尔维亚问题的时候了’;德皇威廉二世也叫嚷‘这是千载难逢的机会……
- There were a lot of computers at the exhibition, to my satis
- 1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于() A.9.0B. 9.5
- 将钠、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体的体积比为 A.1:2:3
- SO2的催化氧化反应(2SO2+O22SO3)是一个放热的反应。如果反应在密闭容器中进行,下列有关说法中正确的是() A
- 2007年10月24日,中国第一颗探月卫星“嫦娥一号”在西昌卫星发射中心成功升空。“嫦娥一号”的成功发射,标志着中国的深
- 阅读下面文言文,按要求答题。 (孟子)对(齐宣王)曰:“王请无好小勇。夫抚剑疾视”曰:‘彼恶敢当我哉!’此匹夫之
- 保护环境是我们共同关注的社会问题. (1)煤的主要成分为碳,碳在空气中燃烧的化学方程式为: .现代工业将CO和H2在催化
- 如果,那么x=________;如果,那么________.
- The course will start in (十二月).
- 对漫画(下图)中“只有翅膀是不够的,还要有对蓝天的渴望”这句话理解最恰当的是( )A.意识具有自觉选择性
- (4分)如图所示是牙膏及其盖的照片,请你仔细观察,它都涉及到了哪些物理知识?
- 下列各句中没有语病的一句是() A.在这次会晤中,麦奇杰和杨旭代表广药向戚务生介绍了广药集团入主广州足球和全力争取广州队
- 三角形两条边长分别为2和3,其夹角的余弦值是方程2x2-3x+1=0的根,则此三角形周长为() A. B.7 C.5+
- 由5个大小相同的正方体组成的几何体如图所示,其主视图是( )A. B. C. D.
- Louis Armstrong, the most influential jazz musicians,is cons
- 下图为脉胞霉体内精氨酸的合成途径示意图。从图中不可得出的是A.精氨酸的合成由多对基因共同控制 B.若产生鸟氨酸依赖型(即



