高中 化学
 +Ba2+═BaSO4↓
B . 氯化镁溶液与氨水反应:Mg2++2OH﹣═Mg(OH)2↓
C . 氢氧化铝与稀硝酸反应:Al(OH)3+3H+═Al3++3H2O
D . 钠与水反应:2Na+2H2O═2Na++OH﹣+H2↑
+Ba2+═BaSO4↓
B . 氯化镁溶液与氨水反应:Mg2++2OH﹣═Mg(OH)2↓
C . 氢氧化铝与稀硝酸反应:Al(OH)3+3H+═Al3++3H2O
D . 钠与水反应:2Na+2H2O═2Na++OH﹣+H2↑

 是一个吸热反应
B .
是一个吸热反应
B .  的总能量大于
的总能量大于  和
和  的能量之和
C . 形成
的能量之和
C . 形成  中的化学键需要放出
中的化学键需要放出  的能量
D .
的能量
D .  和
和  的能量之和为
的能量之和为 
![]()
 C . 甲醛的结构简式:HCHO
D . 羟基的电子式:
C . 甲醛的结构简式:HCHO
D . 羟基的电子式: 
下列说法错误的是( )
 2CO(g)向正反应方向移动
C . 1000℃时,测得某时刻x(TiCl4)=0.2.其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4)
D . 实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高
2CO(g)向正反应方向移动
C . 1000℃时,测得某时刻x(TiCl4)=0.2.其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4)
D . 实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高
 2NH3(g),平衡时,体系中氨的体积分数(NH3)随压强变化的情况如表:
2NH3(g),平衡时,体系中氨的体积分数(NH3)随压强变化的情况如表: 压强/MPa | 10 | 20 | 30 | 40 |
φ(NH3) | 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
 D . 30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动
D . 30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动

-
(1) 固体B是(填化学式)。
-
(2) 第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:;
-
(3) 第③步中,生成氢氧化铝的离子方程式是,若往A溶液中通入足量CO2 , 产生的沉淀为(填化学式)。
-
(4) 工业上制取AlCl3常用Al2O3与碳单质、氯气在高温条件下反应,已知每消耗0.5molC,转移1mol电子,则该反应的氧化产物为(填化学式)。
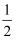 ;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
-
(1) 用电子式表示A和E形成化合物的过程.
-
(2) 写出F原子的核外电子排布式.
-
(3) 写出A2D的电子式,其分子中(填“含”或“不含”)σ键,(填“含”或“不含”)π键.
己烷雌酚的一种合成路线如下:

下列叙述正确的是( )
![]() A.在NaOH水溶
A.在NaOH水溶![]() 液中加热,化合物X可发生消
液中加热,化合物X可发生消![]() 去反应
去反应
B.在一定条件下,化合物Y可与HCHO发生缩聚反应
C.用FeCl3溶液可鉴别化合物X和Y
D.化合物Y中不含有手性碳原子
水和双氧水(H2O2)具有相同的组成元素。请回答下列问题:
(1)水是生命之源,我国水资源总量虽位居世界第六位,但人均水量很少。请你写出一条节约用水的方法____________________________________。
(2)实验室用5%过氧化氢溶液制氧气,为加快反应速率常加入少量二氧化锰,其中二氧化锰的作用是______________________。
(3)水通常只能在电解的情况下分解,假如能同双氧水分解一样,寻找到一种加速水分解的催化剂,则该催化剂将对人类社会产生怎样的影响?____________________________(任答一点)。
(4)根据已学知识,请你写出一个有水生成的化学反应文字表达式____________________。
下列离子方程式的书写及评价,均合理的是
| 选项 | 离子方程式 | 评价 |
| A. | 将2mol Cl 2 通入到含1mol FeBr 2 的溶液中: 2Fe 2+ +2Br - +2Cl 2 = 2Fe 3+ +4Cl - +Br 2 | 正确;Cl 2 过量,可将Fe 2+ 、Br - 均氧化 |
| B. | Mg(HCO 3 ) 2 溶液与足量的NaOH溶液反应: Mg 2+ + HCO 3 - + OH - = MgCO 3 ↓+ H 2 O | 正确;酸式盐与碱反应生成正盐和水 |
| C. | 过量SO 2 通入到NaClO溶液中: SO 2 + H 2 O + ClO - = HClO+HSO 3 - | 正确; 说明酸性: H 2 SO 3 强于HClO |
| D. | 1mol/L的NaAlO 2 溶液和2.5mol/L的HCl溶液等体积互相均匀混合: 2AlO 2 - + 5H + = Al 3+ + Al(OH) 3 ↓+ H 2 O | 正确;反应后溶液中与沉淀中铝元素质量相等 |
A . A B . B C . C D . D
食品包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂,理由是(用化学方程式表示)_________________
___________________。
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?举出一例。
(1)选用下图所示的装置(可以重复选用)进行实验,装置接口依次连接的合理顺序为:a→___________。

(2)装置A盛氯化钠固体的仪器名称是___________,装置C中试剂是___________。
(3)实验开始时,通入HC1和N2,将管式炉I,Ⅱ升温至150℃,装置D中发生的化学反应方程式为___________;此时通入N2的目的是______________________;
(4)反应一段时间后保持管式炉I、Ⅱ温度为350℃,保证将水除尽,再______________________;(填操作)最后在氮气保护下将氯化锌刮出玻璃管外,保存待用。
(5)若称取100.00g市售氯化锌样品,经提纯最终得到高纯氯化锌100.3g,则样品中氯化锌纯度为___________。
- 下列有关碳和碳的化合物说法错误的是()。 A. 金刚石、石墨、C60都是碳元素组成的单质 B. 在加热或高温的条件下,C
- 某正三价金属元素A,它的氧化物中含氧元素的质量分数是30%,则A的相对原子质量是 ( ) A.56 B.
- 在水平气压梯度力和地转偏向力共同作用下,风向最终 ( ) A.与等压线垂直
- 根据拼音在田字格内写出相应的汉字,要求书写美观、规范、工整。(4分)(自编)(A) 根据市教育局“三进”工作常态
- 把下列句子组成语意连贯的一段话。(只填序号) ①东岸的风光不同,与西岸形成令人赞叹的对比。
- “中国的油价比美国还贵”,针对这一抱怨,一位赞同涨价的环保人士把各主要国家的油价折合成人民币做了一个比较(如图),他这
- 史学界一般认为夏朝是中国古代第一个国家政权,主要依据是 ( ) A、禹是公认的部落联盟的首领 B、
- 下图是1949—2008年中国与外国建交情况曲线图。在下列各项中,建交最高峰出现的主要原因是Ww w.ks5 u.co
- 溶液和胶体具备的共同性质是() A.分散质微粒都能透过半透膜 B.用石墨电极做导电性实验时,分散质微粒都定向且朝一个方向
- 下列关于世界观与方法论的看法,正确的选项是( ) ①世界观与方法论是同一问题的两个方面②一般说来,世界观决定方法论,
- 下列加点字注音全对的一项是() A.彷徨(páng)矫作(jiǎo)伦理(lún) B.狡黠(jié) 诘难(jié)
- 下列关于鉴定实验操作步骤的叙述中,正确的是()A. 用于鉴定还原糖的斐林试剂甲液和乙液可直接用于蛋白质的鉴定 B. 鉴定
- 下列有关分子的知识,正确的是 A.水变为水蒸气,说明分子受热变大 B.打开浓氨水的试剂瓶,能闻到
- (一)旅夜书怀杜甫细草微风岸,危樯独夜舟。 星垂平野阔,月涌大江流。 名岂文章著,官因老病休。 飘飘何所似,天地一沙鸥。
- 此题要求改正所给短文中的错误。对标有题号的每一行作出判断:如无错误,在该行右边横线上画一个勾(√);如有错误(每行只有一
- 如图所示,回答问题.(1)仪器a的名称是. (2)实验室用高锰酸钾制取氧气的化学方程式为,可选用的收集装置是(填字母).
- Howlong does it _______to go there by plane? A. spent
- 《人民日报》载文指出,在对人们进行人文教育的过程中,应当加大科学精神的含量,把科学精神作为反对封建迷信、邪教非法活动、伪
- 如图(1)放置两个全等的含有30°角的直角三角板与,若将三角板向右以每秒1个单位长度的速度移动(点C与点E重合时移动终止
- 2010年,江苏省固定资产投资总量较快增长,全年共完成23186.8亿元,其中国有及国有控股企业、外资企业、民间企业投资



