高中 化学
⑴X、Y、Z的单质在常温下均为气体;
⑵X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
⑶XZ极易溶于水,在水溶液中电离出X+和Z﹣ , 其水溶液能使蓝色石蕊试纸变红;
⑷每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑸Z单质溶于X2Y中,所得溶液具有漂白性.
试写出其元素符号:X,Y,Z,以及化合物的分子式:XZ,X2Y.
 的
的 溶液中加入
溶液中加入 的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时,
的盐酸(混合后溶液的体积变化忽略不计)。已知25℃时, 。请回答下列问题:
。请回答下列问题:
-
(1) 混合后溶液的pH=。
-
(2) 混合后溶液中
 mol/L(写出计算过程)。
mol/L(写出计算过程)。
| 实验 | 结论 | |
| A | 某有机物完全燃烧,只生成CO2和H2O | 该有机物属于烃类物质 |
| B | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中羟基上的氢与水分子中的氢具有相同的活性 |
| C | 向苯酚溶液中滴加几滴浓溴水,无白色沉淀生成 | 苯酚与浓溴水不反应 |
| D | 将铜丝在酒精灯外焰上加热,变黑后再移至内焰,变黑的铜丝恢复红色 | 酒精灯内焰有挥发出的乙醇蒸气,将变黑的铜丝还原 |
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。 
请回答下列问题:
-
(1) 盛放浓盐酸的仪器名称是,a的作用为。
-
(2) b中采用的加热方式的优点为,b中反应的化学方程式为。
-
(3) c中采用冰水浴冷却的目的是。
-
(4) d中可选用试剂___________(填标号)。A .
 B . NaCl
C .
B . NaCl
C .  D .
D . 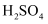
-
(5) 反应结束后,取出b中试管,经冷却结晶,,洗涤,干燥,得到
 晶体。
晶体。
-
(6) 取少量
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入  振荡,静置后
振荡,静置后  层显色。可知该条件下NaClO的氧化能力
层显色。可知该条件下NaClO的氧化能力  (填“大于”或“小于”)。
(填“大于”或“小于”)。
-
(1) 合金在生活中的应用很普遍,其优点是,常见的合金有.
-
(2) 金属的腐蚀使我们生活中常看到的现象.家用铁锅洗后容易生锈,请举出一种避免生锈的办法.
-
(3) 服用药物时要对症下药.以碳酸氢钠为主要成分的药物适合治疗.
-
(4) 蛋白质是生命的基础,没有蛋白质就没有生命.蛋白质的基石是.常利用(填“盐析”“变性”或“颜色反应”)分离、提纯蛋白质.
①气体的质量为,气体中含氢原子的物质的量为 mol。
②气体中所含分子数为。
③气体在标准状况下的体积为。
④将气体甲完全溶解于水中形成500mL溶液,所得溶液溶质的物质的量浓度为 mol•L-1。
⑤将④中所得溶液取出100mL,加水稀释至1000ml,所得溶液溶质的物质的量浓度为 mol•L-1。

-
(1) 上述反应中生成二氧化硫的化学方程式为
-
(2) 乙同学认为还可能产生氢气的理由是
-
(3) 丙同学在安装好装置后,必须首先进行的一步操作是
-
(4) A中加入的试剂可能是,作用是;B中加入的试剂可能是,作用是;E中加入的试剂可能是,作用是.
-
(5) 可以证明气体X中含有氢气的实验现象是C中:,D中:.如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?(填“能”或“不能”),原因是.
(1)NaHCO3和NaHSO4的溶液混合后,实际参加反应的离子是________。
(2)实验室中不能用硫化钠溶液和氯化铝溶液混合来制取硫化铝,原因是______
(用化学方程式表示)。
(3)溶液中SO32-与H+不能大量共存,是因为发生了_________反应,酸性条件下NO3-与Fe2+不能大量共存,是因为发生了_________反应(填反应类型)。
(4)只选用一种试剂就能把浓度均为1 mol·L-1的Na2SO4、Na2SO3、Na2CO3、BaCl2溶液加以区别,这种试剂是。
A.CaCl2 B.AgNO3 C.H2SO4 D.NaOH
某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:

下列有关三种金属的说法中正确的是( )
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
(1)氯水有漂白作用,是由于其中含具有漂白性的__________(填“![]() ”或“
”或“![]() ”)的缘故。奶粉中________(填“蛋白质”或“葡萄糖”)含量不足,将导致食用这种奶粉的婴幼儿营养不良。
”)的缘故。奶粉中________(填“蛋白质”或“葡萄糖”)含量不足,将导致食用这种奶粉的婴幼儿营养不良。
(2).属于人体生命活动必需的微量元素是__________(填“Fe”、“H” 或“Na” );钢铁暴露在潮湿空气中发生电化学腐蚀的实质是:钢铁表面的水膜与铁和碳组成了无数微小的________________。
(3).蛋白质是构成生命的基础物质,是日常膳食的重要组成部分。下列食物中富含蛋白质的是_______(填序号)。①苹果 ②葡萄糖 ③牛奶
下列离子方程式正确的是( )
A.向氢氧化钡溶液中加硫酸溶液 Ba2+ + SO42- ![]()
![]() BaSO4 ↓
BaSO4 ↓
B.用食醋与苏打溶液反应(主要成分是碳酸钠) 2CH3COOH + CO32- ![]()
![]() 2CH3COO- + CO2↑ +H2O
2CH3COO- + CO2↑ +H2O
C.石灰乳与碳酸钠溶液混合Ca2+ + CO32- ![]()
![]() CaCO3 ↓
CaCO3 ↓
D.氧化铁溶于稀硝酸 Fe2O3 + 6H+ ![]()
![]() 2Fe3+ + 3H2O
2Fe3+ + 3H2O
在下列过程中,需要加快化学反应速率的是( )
A. 钢铁腐蚀 B. 食物腐败 C. 炼钢 D. 塑料老化
下列仪器名称为“容量瓶”的是
![]() A.
A.![]() B.
B.![]() C.
C.![]() D.
D.
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1mol二甲醚中含有的C—O键的数目为2NA
B.标准状况下,44.8L HF中含有分子的数目为2NA
C.200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA
D.在反应Cu2S+O2![]() 2Cu+SO2中,每生成1molCu,转移电子的数目为2NA
2Cu+SO2中,每生成1molCu,转移电子的数目为2NA
NA表示阿伏德罗常数的值,下列叙述正确的是
A. 标准状况下,33.6 L H2O含有的H2O分子数为1.5 NA
B. 常温常压下,32g O2和28 g N2所含分子个数比为1:1
C. 0.5 mol/L AlCl3溶液中含有的Cl 数为1.5 NA
D. 1 mol Na2O2与足量CO2完全反应转移的电子数目为2 NA
已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是
A. 2Fe3++SO2+2H2O=2Fe2+ +SO42-+4H+
B. I2+SO2+2H2O=H2SO4+2HI
C. H2O2+H2SO4=SO2+O2+2H2O
D. 2Fe3++2I-=2Fe2++I2
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.加入苯酚显紫色的溶液:Cu2+、 NH4+、 Cl-、SCN-
B.无色透明的溶液:Na+、 Fe2+、![]() 、
、 ![]()
C.![]() =10-2 mol/L的溶液:K+、Na+、
=10-2 mol/L的溶液:K+、Na+、 ![]() 、CH3COO-
、CH3COO-
D.能使酚酞变红的溶液:Mg2+、 Ba2+、ClO-、 I-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br-
B.加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO-
C.含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I-
D.c(OH-)<![]() 的溶液:ClO-、NO3-、Na+、Ca2+
的溶液:ClO-、NO3-、Na+、Ca2+
- 某小区的两栋楼之间新开了一家烤鸭店,“嗡嗡”的噪声和刺鼻的炭焦味让附近居民苦不堪言。对此,居民可以 (
- 藏传佛教在玉树州老百姓的生活中占有重要地位。2010年4月28日,在地震中受损严重的结古镇禅古寺的喇嘛们进行了灾后首场法
- 某地考核领导干部有新规定,群众投票不满意率达到50%就不称职,不称职者将进行组织调整或降职安排。这反映了我国公民通过 A
- 《史记》载,“封诸侯,班赐宗彝,作分殷之器物。 ,乃褒封神农之后于焦,黄帝之后于蓟,帝尧之后于杞,大禹之
- 一探照灯照射在云层底面上,这底面是与地面平行的平面,如图所示,云层底面高h,探照灯以匀角速度ω在竖直平面内转动.当光束转
- 太平天国运动的最主要历史功绩是 A.加速了清王朝和整个封建制度的衰落与崩溃 B.担负起反侵略反封建的双重任务 C.
- 有人认为,既然经济建设是所有工作的中心,一切活动都必须围绕经济建设展开,那么弘扬和培育民族精神是可有可无的事。 这种看法
- 第二节 语法填空(共10小题,每小题1.5分,满分15分) 阅读下面短文,按照句子结构的语法性和上下文连贯的要求,在空格
- 下列对植物激素的叙述中,不正确的是 A.它在植物体内含量极少 B.它对植物生命活动具有调节作用
- 下列各句中有语病的一项是( )。(2分)A.任何单位和个人在食品生产中禁止使用食品添加剂以外的任何化学物质和其他
- 实数在数轴上的位置如图示,化简|a-1|+ 。
- 在我国古代,秦朝设丞相,明朝废丞相。下列对这种现象的分析,正确的是( ) A.都是君主专制统治的需要
- 西学东渐过程中,在中国产生较大影响的各种思潮出现的先后顺序是( ) ①民主与科学 ②民主共和 ③君主立宪 ④马
- 如图是实验室制取气体的部分装置.(1)写出仪器①、②的名称①;②. (2)在用上面的两套装置制取气体前,我们首先要. (
- ......
- “封建亲戚,以藩屏周。”说明西周时期实行分封制的主要目的是( ) A.分割诸侯的兵力
- “微观﹣宏观﹣符号”三重表征是化学独特的表示物质及其变化的方法.请结合图示完成下列问题:(1)图1中,“Cu”表示多种
- 如图,在△ABC中,AB=AC,AD是BC边上的中线,以AD为直径作⊙O,连接BO并延长至E,使得OE=OB,连接AE.
- 如图所示,固定位置在同一水平面内的两根平行长直金属导轨的间距为d,其右端接有阻值为R的电阻,整个装置处在竖直向上磁感应强
- 既是近代第一批开放的通商口岸,又是改革开放后第一批开放的经济特区的城市是A.厦门 B.上海 C.广州 D



