高中 化学
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告.
-
(1) 实验目的:研究元素性质的递变规律
-
(2) 实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①,②,③,试管夹,镊子,小刀,玻璃片,砂纸,火柴等.
-
(3) 实验内容:(填写与实验步骤对应的实验现象的编号和③、⑥的反应方程式)
实验内容
①
②
③
④
⑤
⑥
实验现象(填A﹣F)
实验步骤③涉及的化学方程式,实验步骤 ⑥涉及的离子方程式.
-
(4) 实验结论:.
某澄清透明溶液中只可能含有①Al3+;②Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO32-⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )

-
(1) 图中,A管的作用是制取乙炔的化学方程式是:
-
(2) 乙炔通入KMnO4酸性溶液中观察到的现象是,乙炔发生了反应.
-
(3) 乙炔通入溴的CCl4溶液中观察到的现象是,乙炔发生了反应.
-
(4) 为了安全,点燃乙炔前应,乙炔燃烧时的实验现象是.
-
(1) 根据结构对有机物进行分类,有助于对其性质的掌握。
① 有机物苯属于(填字母)。
a.芳香烃 b.烯烃 c.炔烃
② 下列有机物属于酚类的是(填字母)。

③ 纤维素属于(填字母)。
a.糖类 b.油脂 c.蛋白质
-
(2) 柴胡红景天中的活性成分之一是鞣花酸(结构式如右图)。

①鞣花酸的分子式为;
②鞣花酸分子中含氧官能团为和(写名称);
③1mol鞣花酸最多可与mol Br2发生取代反应;
1mol鞣花酸最多可与含mol NaOH的溶液发生反应.
-
(3) 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.

①区别两种酸的方法是。
莽草酸与溴水的反应方程式:。
②等物质的量的两种酸与足量NaOH溶液反应,消耗氢氧化钠物质的量之比是。
③鞣酸的核磁共振氢谱图(H核磁共振谱图)上有个吸收峰。
-
(1) 大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如下表:
物质
H2(g)
C(石墨,s)
C6H6(l)
燃烧热




则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为。
-
(2) CH4与CO2重整是CO2利用的研究方向之一。该重整反应体系主要涉及以下反应︰
a.CH4(g) + CO2(g) =2CO(g) +2H2(g) △H1
b.H2(g)+ CO2(g) = CO(g)+ H2O(g) △H2
c.CH4(g) =c(s) +2H2(g) △H3
d.2CO(g)=c(s)+CO2(g) △H4
e. H2(g)+ CO(g)=C(s)+H2O (g) △H5;
上述反应体系在一定条件下建立平衡后,下列说法正确的有。(填字母)
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、 e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率D.降低反应温度,反应a~e的正、逆反应速率都减小
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程经历了步反应,其中第步的正反应速率最慢。
-
(3) 以CO2、H2为原料合成CH3OH的主要反应如下:
I.

II.

III.

不同压强下,按照
 投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=

CH3OH的平衡产率=

其中纵坐标表示CO2平衡转化率的是图(填“甲”或“乙”);压强p1、P2、P3由大到小的顺序为;图乙中T1温度时,三条曲线几乎交于一点的原因是。
-
(4) 恒压下,按照
 投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是。
投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是。

 D .
D . 
| 实验 | 操作或结论 |
| A.浓硫酸加入到蔗糖中 | 蔗糖变黑体现了浓硫酸的吸水性 |
| B.实验室收集NO | 可用排空气法收集 |
| C.SO2通入高锰酸钾溶液 | 高锰酸钾溶液褪色,说明SO2具有漂白性 |
| D.CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
 分两步进行:Ⅰ.
分两步进行:Ⅰ.  ,Ⅱ.
,Ⅱ.  ,其反应过程能量变化如图1所示。在其它条件相同时,分别在
,其反应过程能量变化如图1所示。在其它条件相同时,分别在 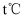 和
和  测得c(NO)随时间(t)的变化关系如图2 所示。下列说法错误的是( )
测得c(NO)随时间(t)的变化关系如图2 所示。下列说法错误的是( ) 
 B . 反应Ⅱ是总反应的决速步骤
C . 升高温度总反应速率一定增大
D . 反应中只有部分分子发生有效碰撞
B . 反应Ⅱ是总反应的决速步骤
C . 升高温度总反应速率一定增大
D . 反应中只有部分分子发生有效碰撞
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是
A.切开的苹果和纸张久置在空气中变黄原理一致
B.铁制品和铜制品均能发生吸氧和析氢腐蚀
C.高温加热和“84”消毒液均可杀死禽流感病毒
D.根据我国最新垃圾分类标准,废旧干电池属于可回收垃圾
下列有关纯铁的描述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
X、Y、Z三种物质有如下的转化关系:

试推断:
![]() 、Z的化学式分别为:X______,Z______.
、Z的化学式分别为:X______,Z______.
![]() 试剂甲为______溶液.
试剂甲为______溶液.
氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以A为原料合成该药物的路线如图:

(1)A的化学名称是__,C中的官能团除了氯原子,其他官能团名称为__。
(2)A分子中最少有__原子共面。
(3)C生成D的反应类型为__。
(4)A与新制Cu(OH)2反应的化学方程式为__。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有__种。
①除苯环之外无其他环状结构;②能发生银镜反应。③苯环上有只有两个取代基。
其中核磁共振氢谱中有4个吸收峰,且峰值比为2∶2∶2∶1的结构简式为__。
(6)已知:
![]()
![]()
 ,写出以苯甲醇为有机原料制备化合物
,写出以苯甲醇为有机原料制备化合物 的合成路线(无机试剂任选)__。
的合成路线(无机试剂任选)__。
下列物质中属于离子化合物的是
A. CaF2 B. NH3 C. H2SO4 D. Na
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.23 g Na与足量H2O反应完全后可生成NA个H2分子
B.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4 L N2和H2混合气中含NA个原子
D.3 mol单质Fe完全转变为Fe3O4,失去8NA个电子
在盐类的水解过程中,下列各种情况必定发生的是( )
A.盐的电离平衡被破坏 B.溶液温度升高
C.25℃,溶液的pH不是7 D.水的电离平衡被破坏
据权威刊物报道, 1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是( )
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体
C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+
D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展
- 噬菌体侵染细菌后可以使细菌死亡,HIV感染T细胞后可以造成T细胞大量死亡,那么噬菌体和HIV利用细菌和T细胞中的物质主要
- 汽油机工作时,在 冲程,将内能转化为机械能。
- 2013年某品牌电子商务平台“双十一”网上购物交易金额高达350.19亿元,并产生了约1.67亿件快递量。据此完成25-
- 如图所示,光滑轨道MNP固定在竖直平面内,NP段水平。一小球从M点由静止释放运动到P点的过程中,动能、势能的变化情况是
- 下表是2014年7月-2015年7月,赵某的投资情况,你认为让赵某改变投资结构比例的原因,最可能的有①国家上调人民币存贷
- —Why aren’t they here yet? —They _______the bus.
- 已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为: C(石墨)+O2(g)=== CO2(g) △H=
- 分子式为C2H6O的化合物A具有如下性质: A+Na慢慢产生气泡 A+CH3COOH有香味的产物 (1)根据上述信息,对
- 甲、乙两辆汽车沿平直公路从某地同时驶向同一目标,甲车在前一半时间内以速度v1做匀速直线运动,后一半时间内以速度v2做匀速
- 据中国人民银行统计,2009年1~12月份,我国居民户存款余额的同比增幅在29%以上。经济学家把中国居民在银行的存款形象
- 将紫色水萝卜的块茎切成小块放进水中,水的颜色无明显的变化,若进行加热,随着水的温度增加,水的颜色逐渐变红,其原因是()
- 中国近代史上俄国是侵略中国的主要国家之一。下列外国列强侵华史实中俄国参与的有 ①鸦片战争 ②第二次鸦片战争
- 在如图所示的电路中,电源电压保持不变,当开关s由断开到闭合时,下列说法中正确的是( ) A.电流表的示数减小,
- 对价值观的理解,错误的是( ) A.价值观是一种社会意识 B.价值观是社会存在的反映 C.价值观
- 阅读下面这首唐诗,完成8-9小题。 春日山居寄友人
- 如图所示,一质量为M=0.4kg的光滑半圆形凹槽放在光滑水平面上,凹槽的半径为R=0.25m,另一质量为m=0.1kg的
- [三](15分)【甲】万钟则不辩礼义而受之,万钟于我何加焉!为宫室之美、妻妾之奉、所识穷乏者得我与?乡为身死而不受,今为
- 成长是一首诗,咏叹着时光的幸福回忆;成长是一支歌,跌宕着岁月的欢乐感伤;成长是一幅画,渲染出生命的七彩真谛。成长是年龄上
- 有关氨气的实验较多,下面对这些实验原理的分析中,正确的是() A、氨气极易溶于水,可以用来做喷泉实验 B、氨气的还原性可
- 1928年中共六大通过的《政治议决案》指出:各省自发的农民游击战争,只有和“无产阶级的城市的新的革命高潮相联结起来”,才



