高中 化学
I.碳化铝(Al4C3)与水反应可制得CH4。
II.银氨溶液{含[Ag(NH3)2]+、OH-与CO反应产生银镜(Ag)。
III.CH4被CuO氧化的氧化产物为CO和CO2。
某学习小组对III表示质疑并在老师的指导下进行实验探究。回答下列问题:

-
(1) 写出甲装置中反应的化学方程式。
-
(2) 该实验装置的接口连接顺序为(填字母),连接好装置后,进行的第一步实验操作为。
-
(3) 乙装置的作用是,丙中实验现象是。
-
(4) 若丁、戊两装置中出现了特征实验现象,则说明反应产生了(填化学式)。综合以上实验现象,CH4和CuO的反应还有一种产物没有检验,若要检验该产物,应。

已知:
CH3CH=CHCH2CH3  CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
回答下列问题:
-
(1) 香豆素分子中的官能团的名称为,步骤Ⅱ→Ⅲ的反应类型为。
-
(2) 有机物Ⅲ的结构简式为。在上述转化过程中,设计反应步骤Ⅱ→Ⅲ的目的是。
-
(3) 下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是 (填字母)。A . 可用FeCl3溶液来鉴别Ⅱ和III B . Ⅳ中核磁共振氢谱共有4组峰 C . Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色 D . 1molⅡ最多能和2molNaHCO3发生反应
-
(4) 香豆素在过量NaOH溶液中完全水解的化学方程式为。
-
(5) 写出乙二酸和乙二醇(HOCH2CH2OH) 生成Ⅴ的化学方程式为。
-
(6) 化合物Ⅳ有多种同分异构体,符合下列两个条件的芳香族同分异构体共有种。
①遇FeCl3溶液发生显色反应
②能发生水解反应和银镜反应
其中,核磁共振氢谱共有5组吸收峰,且峰面积比为1:2:2:2:1的同分异构体的结构简式为。
 的分子构型也为直线形
B . 单质的熔点
的分子构型也为直线形
B . 单质的熔点 , 则单质的熔点
, 则单质的熔点 C .
C .  、
、 是酸性氧化物,则
是酸性氧化物,则 也是酸性氧化物
D .
也是酸性氧化物
D .  通入
通入 溶液不产生沉淀,则
溶液不产生沉淀,则 通入
通入 溶液也不产生沉淀
溶液也不产生沉淀
 CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )
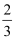 D . 其他条件相同时,若起始充入2molCO2和6molH2 , 达到平衡时CH3OH的物质的量分数大于25%
D . 其他条件相同时,若起始充入2molCO2和6molH2 , 达到平衡时CH3OH的物质的量分数大于25%
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原.
![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B.pH=1的H3PO4溶液中,含有![]() 个
个![]()
C.2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
已知:2[NaAl(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 3 |
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
请回答下列问题:
(1)向Na2CO3和NaHCO3的混合溶液中滴加盐酸0﹣﹣25mL时发生反应的离子方程式为 ,25mL以后时发生反应的离子方程式 ;
(2)混合溶液中Na2CO3和NaHCO3的物质的量之比为 ;
(3)原NaOH溶液中NaOH的物质的量浓度为 ,所通CO2气体的体积在标准状况下为 .


某气体X中可能含有NH3、Cl2、HBr、CO2中的一种或几种。已知将X通入硝酸银溶液中会产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中则没有沉淀产生。则下列有关气体X的说法正确的是( )
A.一定含有溴化氢、二氧化碳 B.可能含有二氧化碳
C.一定不含氨气、氯气 D.可能含有二氧化碳和氯气
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:

(1)①铜帽溶解时加入H2O2的目的是__________________________(用化学方程式表示)。②![]() 铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是______________________________________
铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是______________________________________
___________________________________________________________。
(2)为确![]() 定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-===2CuI(白色)↓+I2 2S2O
定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-===2CuI(白色)↓+I2 2S2O![]() +I2===2I-+S4O
+I2===2I-+S4O![]()
①滴定选用的指示剂为______________,滴定终点观察到的现象为___________________________________________________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4![]() ]2-。下表列出了几种离子生成氢
]2-。下表列出了几种离子生成氢![]() 氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Zn2+ | 5. 9 | 8 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH溶液。由除去铜的滤液制备ZnO的实验步骤依次为:①_________![]() _______;②________________;③过滤;④________________;⑤过滤、洗涤、干燥;⑥900 ℃煅烧。
_______;②________________;③过滤;④________________;⑤过滤、洗涤、干燥;⑥900 ℃煅烧。
如图为铜丝与浓硫酸反应并验证其产物性质的实验装置.


(1)①中反应的化学方程式是 .
(2)②中饱和NaHSO3溶液的作用是除去 .加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是 .
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 |
|
| 第二份 | 加入氯水 | 有白色沉淀生成 |
|
完成上述反应的离子方程式.
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是 .
归纳与推理是化学学习常用的方法。下列推理正确的是
A.因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2
B.同族元素具有相似性。因为CaCO3、BaCO3是白色沉淀,所以SrCO3也是白色沉淀。
C.蔗糖加入浓硫酸后变黑,说明浓硫酸具有吸水性
D.因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性
下列说法正确的一组是
①含氧的化合物一定是氧化物 ②盐的组成中一定含有金属元素
③0.5mol/L一元酸溶液中H+浓度一定为0.5mol/L
④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑤ NASO4电离时生成的阳离子有氢离子,所以是酸
A.①③⑤⑥ B.②④⑤⑥ C.只有⑤ D.只有⑥

已知高能锂电池的总反应式为:2Li + FeS = Fe + Li2S [LiPF6·SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2为4.48 L。下列有关叙述不正确的是( )
A.从隔膜中通过的离子数目为0.4NA
B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为
4mol·L-1
C.A电极为阳极
D.电源正极反应式为FeS+2Li++2e- = Fe+Li2S
- 将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10 g水,并冷却到t ℃时,分别析出2g甲和3g乙物质(均不带结晶水),
- 抒发思乡之情是我国古代诗词曲中的一个经久不衰的主题,其中有许多名句,请你任意写出两句:“
- 化简求值:5x2y﹣[3xy2+7(x2y﹣xy2)],其中x=﹣1,y=2.
- 切除胰腺的狗,所排出的尿液常会招来许多的蚂蚁,原因是( )。 A.尿中含有营养物质 B.尿中有糖 C.蚂蚁
- 下列生活事例中,主要过程为化学变化的是 ( ) A.功夫深,铁杵成针 B.佳节到,焰火缤纷 C.春天来
- 下面①~⑤ 是利用显微镜观察时的几个操作步骤,在显微镜下要把视野里的标本从图中的甲转为乙,其正确的操作步骤是:(
- 分式方程的解为 A. B. C. D.
- 已知反比例函数,在每个象限内y随着x的增大而增大,点P(a-1, 2)在这个反比例函数上,a的值可以是( )A.0B
- 某学校化学学习小组设计出下图所示装置,并进行白磷燃烧实验。 ⑴当烧杯内的水受热,温度计显示30℃时,打开活塞,在盛有水
- 已知(1)HCl和NaOH反应的中和热ΔH=-57.3kJ/mol; (2)CO(g)的燃烧热是283.0kJ/mol;
- I know the feeling of ________________(被忽视) isn’t nice, but
- 下列各图中,反映了秦始皇加强中央集权、巩固统一的有
- 家庭是文明社会的基本细胞。阅读材料,回答问题。 材料一 身修而后家齐,家齐而后国治,国治而后天下平。
- 如图,直角三角形ACB中,CD是斜边AB上的中线,若AC=8cm,BC=6cm,那么△ACD与△BCD的周长差为 2 c
- 不考虑温度对电阻的影响,对于一个“220 V40 W” 的灯泡而言,有关它的工作状态,下列说法中正确的是()A.接在11
- “给力”是对当今一些社会现象的感叹或者认同,原先是少数网友用语,后来成了社会热语,还出现在《人民日报》头版头条的标题中。
- 设向量与的夹角为,且,,则( ) A. B. C. D.
- 阅读下面短文,然后按照要求写一篇150词左右的英语短文。 Oseola McCarty spent morethan 7
- 已知中,内角A、B、C所对边长分别为a、b、c, (I)求B: (II)若a=2.求的面积
- 如图所示,把一个长方形纸片沿EF折叠后,点D,C分别落在D′,C′的位置.若∠EFB=65°,则∠AED′等于(



