高中 化学
 B .
B . 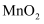 和
和  C .
C . 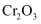 和
和  D .
D .  和FeO
和FeO

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
-
(1) BaTiO3中Ti 元素的化合价为:。
-
(2) 用盐酸酸漫时发生反应的离子方程式为:。
-
(3) 流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有。
②如何证明晶体已洗净?。
-
(4) TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,共目的是:。
-
(5) 某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3 , 得产品13.98g,BaTiO3的产率为:。
-
(6) 流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c([Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为mol/L。
 )的说法,正确的是( )
)的说法,正确的是( )
 2Sn+aM↑+CO2↑,则下列说法中错误的是( )
2Sn+aM↑+CO2↑,则下列说法中错误的是( )
 X一个该原子的基本微粒(质子、中子、电子)的总数是( )
X一个该原子的基本微粒(质子、中子、电子)的总数是( )
①1L0.1 mol·L-1 FeCl3溶液中含Fe3+数目为0.1NA
②5.6g铁粉与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
③0.1mol乙醇与0.1mol乙酸在浓硫酸催化并加热下,生成乙酸乙酯分子数为0.1NA
④60gSiO2中含有的Si-O键和12g金刚石中含有的C-C键的数目均为NA
⑤体积为11.2L的氯气中含有氯原子数约为6.02×1025个
⑥92g的NO2和N2O4混合气体含有的原子数为6NA
⑦10g46%甲酸( HCOOH)水溶液中所含的氧原子数为0.5NA
⑧7.8gNa2O2与足量的水(H218O)反应生成的氧气中所含的中子数为0.5NA
 含Fe2+电镀液
B .
含Fe2+电镀液
B .  含Fe2+电镀液
C .
含Fe2+电镀液
C .  含Zn2+电镀液
D .
含Zn2+电镀液
D .  含Zn2+电镀液
含Zn2+电镀液

| 实验组别 | | 温度/℃ | 形状 |
| Ⅰ | 2.0 | 30 | 块状 |
| Ⅱ | 2.5 | 30 | 块状 |
| Ⅲ | 2.5 | 50 | 粉末状 |
| Ⅳ | 2.5 | 50 | 块状 |
某烧杯中含有0.2mol NH4Al(SO4)2,向其中缓缓加入4mol/L的NaOH溶液180mL,使其充分反应,此时烧杯中铝元素的存在形式( )
A.Al3+和Al(OH)3 B. ![]() C.
C. ![]() 和Al(OH)3 D.Al(OH)3
和Al(OH)3 D.Al(OH)3
氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2・nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2・nH2O中的n值。
(3)试样中Ba(OH)2・nH2O的质量分数为 。
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A、与铝反应产生大量氢气![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B、能使硫氰化钾溶液显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C![]() 、常温下
、常温下![]() 值为13的溶液中:
值为13的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D、在使石蕊试液变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
- 设函数,若对于任意的,都有,则() A. B.
- 能使无色酚酞试液变红的溶液,可使紫色石蕊试液() A.变成红色 B.变成无色 C.变成蓝色 D.不变色
- 下列四个图形分别是四届国际数学家大会的会标,其中属于中心对称图形的有( )
- 为世界奉献一届有特色、高水平的奥运会,是中国人民对世界的庄严承诺,中国也通过实际行动兑现了这个承诺。北京奥运会不仅是一场
- 已知钍234的半衰期是24天,lg钍经过120天后还剩______________g。
- There was a big rock on the road, which the traff
- He always appreciates ______ others. A.to make fun with
- 今年春天,全国菜价组团上演“窜天猴”:“姜你军”“蒜你狠”“向前葱”……蒜的价格尤其出挑。2016年4月大蒜价格为每公斤
- 下列语句排列恰当的一项是( ▲ )(2分)①当然,在表现自己的时候,自身的缺点或不足难免会有所暴露。②表现自己适当地张
- 不透明袋子中装有6个球,其中有5个红球、1个绿球,这些球除颜色外无其他差别.从袋子中随机取出1个球,则它是红球的概率是
- 等腰三角形的一个角是70°,则其余两角为 .
- 在骨的结构中,与骨的长长有关的是A.红骨髓 B.黄骨髓
- 下列词语中加点的字,读音全都正确的一组是 A、金钗(chāi) 三缄其口(jiān) 颔联(hàn)
- 唐朝陶瓷制品中以黄、绿、白或黄、绿、赭、黑等釉色同时交错使用的艺术珍品是A.越窑的青瓷B.刑窑的白瓷C.唐三彩D.景德镇
- 从下列每组A、B、C、D四个选项中,选出一个与句中划线部分意思相同或相近的答案。 I haveto do my ho
- 已知∠α=35°,那么∠α的余角等于() A.35° B.55° C.65° D.145°
- 下列各组词语中,没有错别字的一组是 A.攸长 彷徨 凄婉迷茫 篱墙颓圮 B.葱茏 绿州 急不暇择 揠苗助长 C.
- I don't think the experiment is ___ failure, because ithas p
- 目前全球能源危机,各国政府积极开发新能源。利用植物淀粉解决能源问题的关键是高性能酸性淀粉酶的获取。请完善实验方案,并回答
- 阅读《君子之交淡如水》,完成第20~22题。(共8分)君子之交淡如水①据史料记载,唐朝贞观年间,薛仁贵因“平辽”有功,被





