高中 化学
 ]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组郤制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组郤制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:

-
(1) 配制本实验所需溶液的蒸馏水,均需经煮沸并迅速冷却后再使用,目的是。
-
(2) c中加入少量碳粉的作用是。
-
(3) 为加快反应速率,需将c中试剂温度保持在80~95℃,可采取的加热方式是。
-
(4) 反应开始时,打开
 、
、 , 关闭
, 关闭 的目的是;反应一段时间后,打开
的目的是;反应一段时间后,打开 , 关闭
, 关闭 , c中液体会自动流入
, c中液体会自动流入 中,此时,
中,此时, 中发生的主要反应的化学方程式为。
中发生的主要反应的化学方程式为。
-
(5) 制备结束后,将
 中固液混合物过滤,所得莫尔盐可用(填试剂名称)进行洗涤,洗涤后用烘箱进行烘干。
中固液混合物过滤,所得莫尔盐可用(填试剂名称)进行洗涤,洗涤后用烘箱进行烘干。
-
(6) 实验小组对样品进行纯度检测,取18.000g样品配成溶液,用
 的酸性
的酸性 溶液滴定。消耗酸性
溶液滴定。消耗酸性 溶液30.00mL,该样品的纯度为%(写出计算过程并保留至0.1%)。注:在滴定过程中
溶液30.00mL,该样品的纯度为%(写出计算过程并保留至0.1%)。注:在滴定过程中 。
。
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
 为浅蓝绿色晶体,较硫酸亚铁不易被氧化。
为浅蓝绿色晶体,较硫酸亚铁不易被氧化。
-
(1) 硫酸亚铁铵晶体的制备:

①铁屑需先用碱洗后,再用少量酸洗,酸洗的目的是。
②制备硫酸亚铁过程中,初始时活塞a、b、c的开关状态依次是,反应一段时间后,调整活塞a、b、c的开关状态依次为,最后得到晶体产品。
-
(2) 产品的相关实验:

①硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解,将方程式补充完整(合理即可) 。
□


 □
□ (系数为1时,也要写出)
(系数为1时,也要写出)②为验证甲中残留物含有
 可选用的试剂有(填字母)。
可选用的试剂有(填字母)。a.稀硝酸 b.稀硫酸 c.新制氯水 d.硫氰酸钾
③装置乙中HCl的作用是。实验中,观察到装置丙中有白色沉淀生成,发生的离子反应方程式为。
-
(3) 样品纯度的测定:准确称量20.00g硫酸亚铁铵晶体样品,配制成100mL溶液。取所配溶液20.00mL于锥形瓶中,加稀
 酸化,实验测定其与
酸化,实验测定其与 溶液恰好完全反应。已知:
溶液恰好完全反应。已知: 的摩尔质量是392g/mol,则产品中
的摩尔质量是392g/mol,则产品中 的质量分数为。
的质量分数为。
![]()
![]()
![]()

-
(1) 分离CCl4和H2O:;
-
(2) 除去澄清石灰水中悬浮的CaCO3:;
-
(3) 从含少量KNO3的NaCl溶液中提取NaCl:;
-
(4) 分离乙酸(沸点为118℃)与乙酸乙酯(沸点为77.1℃)的混合物:。

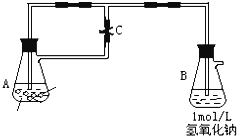
(1)A中药品是 若弹簧夹C打开,B容器中有什么现象发生?
(2)若弹簧夹C关闭一会儿,容器A中的反应还在进行时,B容器中有什么现象发生? 写出B容器中有关反应的化学方程式: .
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )

工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
53.含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
54.纯净的CaCO3和焦炭按①②完全反应,当窑内配比率![]()
![]() =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
55.某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率![]() 为何值?
为何值?
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 温室下其单质呈粉末状黄色固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3个 |
| D | 元素最高正价是+7价 |
| E | 主族元素中得电子能力最强 |
| F | 空气的主要成分之一,其某种元素的同位异形体是保护地球地表环境的重要屏障 |
| G | 第3周期元素的简单离子中半径最小 |
(1)A的气态氢化物的化学式是 ,元素B(含8个中子)的一种同位素可测定文物年代,这种同位素的符号 。
(2)写出元素F的离子结构示意图 。
(3)写出G元素最高价氧化物对应的水化物的化学式是 。
(4)元素D与元素A相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
A.常温下D的单质和A的单质状态不同
B.D的氢化物比A的氢化物稳定
C.一定条件下D和A的单质都能与氢氧化钠溶液反应
(5)A、B、C、D四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
(6)C、E、F、G四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由是 。
(7)F的阴离子和G的阳离子的半径大小比较: (用离子符号表示)
(8)A、D的简单离子的还原性强弱: (用离子符号表示)
下列过程属于熵增加的是
A.一定条件下水由气态变为液态
B.水总是由高处流向低处
C.碳酸氢铵在常温情况下分解
D.CO点燃时生成CO2
下列关于硅及其化合物的说法中,正确的是( )
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
下列实验操作中正确的是
A.制取溴苯:将铁屑、溴水、苯混合加热
B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C.鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
D.检验卤代烃中的卤原子:加入NaOH溶液共热,然后加入稀硝酸至溶液呈酸性,再加AgNO3 溶液,观察沉淀的颜色
用惰性电极电解粗制的饱和食盐水,食盐水装在U形管内。结果很快在某一电极附近出现食盐水浑浊现象。造成浑浊的难溶物主要是 ( )
A.碳酸镁 B.硫酸钡 C.氢氧化镁 D.碳酸钡
下列物质的主要成分属于天然纤维的是
A.聚乙烯 B.尼龙 C.棉花 D.涤纶
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。
下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
- “脱帽露顶王公前,挥毫落纸如云烟”。杜甫的这句诗描述了当时一位书法家的创作情景,这位书法家是() A.欧阳询 B.张旭
- With so much work ________, the manager felt worried. A. doi
- 词汇;根据句意及首字母提示补全单词。 1.Soccer is p___________ all over the wor
- (13分)风压就是垂直于气流方向上单位面积所受到的风的压力。某工科大学的学生研究小组进行了风洞实验,研究风速和风压之间的
- 已知甲组数据的平均数为甲,乙组数据的平均数为乙,且甲=乙,而甲组数据的方差为S2甲=1.25,乙组数据的方差为S2乙=3
- 下列物质中,能与碘作用呈深蓝色的是( )A.淀粉 B.纤维素
- 阅读下面的文言文,完成8~11题。 韩擒字子通,河南东垣人也,后家新安。少慷慨,以胆略见称,容貌魁岸,有雄杰之表。性又好
- (甲)予观夫巴陵胜状,在洞庭一湖。衔远山,吞长江,浩浩荡荡,横无际涯;朝晖夕阴, 气象万千。此则岳阳楼之大观也。前人之述
- 单项填空 I’d like a______for dessert(甜点). Fruit, you know, is go
- 掷一枚质地均匀的正方体骰子(六个面上分别刻有1到6的点数),向上一面出现的点数大于2且小于5的概率为
- 从Fe、C、H、O、N五种元素中选择适当的元素按要求填空 ⑴用适当的符号和数字填空: ①2个铁离子___
- 图2是某地实测的海拔高程,读图完成3~4题。3、图中地形的大致走向是() A.东西 B.南北 C.东北
- (3分)做曲线运动的物体在某一点的瞬时速度的方向就是通过这一点的曲线的________方向,因而做曲线运动的物体速度的方
- 被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水
- 如图所示的LC振荡电路中电感线圈中的磁场能正在________(填“增加”或“减小”),再过Δt=时电路中电容器极板间的
- (2011•四川省资阳市) 9.缩写下段文字。(字数在80字内)(2分) 松鼠的窝通常搭在树枝分叉的地方,又干净又暖和。
- 公安机关已对海宁“2·15”特大火灾中非法进行迷信活动的周某实施刑事拘留,卢某等两人实施监视治疗。据了解,此次非法迷信活
- 某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。(1)A处是气体发生装置,A中所用的试剂
- 单项填空 Ican’t tell you what shesaid. I’ve promised ______ it a
- 生长于较弱光照条件下的植物,当提高CO2浓度时,其光合作用速度并未随之增加,主要限制过程是 A.呼吸作用和暗反应



