高中 化学
X | ||
Y | ||
Z |
-
(1) I.NaNO2和食盐外观很像,曾出现误把NaNO2当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如NaNO2能把Fe2+氧化成Fe3+。已知NaNO2水溶液呈碱性,AgNO2是一种难溶于水白色固体。NaCl溶液呈中性。试回答下列问题:
人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐,如NaNO2 , 则导致血红蛋白中的Fe2+转化为Fe3+而中毒(FeCl2溶液为浅绿色,FeCl3溶液为棕黄色),可以服用维生素C解毒,维生素C在解毒的过程中表现出(填“氧化”或“还原”)性。
-
(2) 下列方法中,不能用来区分NaNO2和NaCl的是__________。A . 测溶液的酸碱性 B . 加入AgNO3溶液观察是否有沉淀生成 C . 分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
-
(3) II. H3PO2是精细磷化工产品。工业制备原理如下:
a.2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
b.Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
下列推断正确的是__________
A . 反应a是氧化还原反应,反应b是复分解反应 B . H3PO2中P化合价是+1 C . 在反应a中发生氧化反应与还原反应的原子个数之比为1:1 -
(4) 某离子反应涉及到H2O、ClO-、NH
 、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程,ClO-表现出性。
、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程,ClO-表现出性。 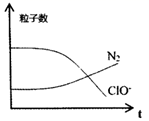
-
(5) 用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴入物质M的饱和水溶液,继续煮沸至液体呈红褐色,停止加热。写出该过程反应的化学方程式。
 ﹣NMR(核磁共振)可用于含碳化合物的结构分析,
﹣NMR(核磁共振)可用于含碳化合物的结构分析,  表示的是( )
表示的是( )
-
(1) I.
 ,反应过程的能量变化如图所示:
,反应过程的能量变化如图所示: 
已知2mol
 和
和  反应生成为1mol
反应生成为1mol  的
的  ,请回答下列问题.
,请回答下列问题.该反应通常用
 作催化剂,加
作催化剂,加  会使图中B点(填“升高”或“降低”).
会使图中B点(填“升高”或“降低”). -
(2) 图中
 .
.
-
(3) 如果反应速率
 为
为  ,则
,则  .
.
-
(4) II.已知下列热化学方程式:
①


②


③


④


回答下列问题:
上述反应中属于熵减反应的是;(写序号)
-
(5) 燃烧20 g
 生成液态水,放出的热量为;
生成液态水,放出的热量为;
-
(6) 写出CO燃烧的热化学方程式;
-
(7) 写出制水煤气的热化学方程式.
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
-
(1) 该烃分子的摩尔质量.
-
(2) 确定该烃的分子式.
-
(3) 已知该烃的一氯代物只有一种,写出该烃的结构简式.

已知:①A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
②G的结构简式为: ![]() ;
;
③ ![]() 。
。
回答下列问题:
-
(1) A的名称是;B→C的反应类型是。
-
(2) G的分子式为;G中官能团名称是;1 mol G与NaOH溶液反应最多消耗 mol NaOH。
-
(3) H的结构简式为。
-
(4) D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式。
-
(5) I与F互为同分异构体,则满足下列条件的I的结构有种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
-
(6) 根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):。
-
(1) 工业废水中含有重金属离子Cu2+ , 需要将其转化沉淀除去,请选择合适沉淀剂.已知常温下:
Cu(OH)2 KSP=2.2×10﹣23
CuS KSP=6.3×10﹣36
-
(2) ①完成表格办1mol/L下列离子,沉淀完全阳离子浓度为10﹣5 mol/L
Fe2+
Fe3+
Cu2+
开始沉淀时pH
完全沉淀时pH
8
3.2
6.7
②能否控制pH将三种离子逐一分离出溶液.
浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48L(标准状况)。试计算:
(1)反应后生成硫酸铜的物质的量。
(2)若将反应后的溶液稀释至500mL,计算该溶液中硫![]() 酸铜的物质的量浓度。
酸铜的物质的量浓度。
用下列装置进行的实验, 能达到相应实验目的的是

A. 用装置①配制一定浓度的硫酸溶液
B. 用装置②分离溶解在CCl4中的 I2
C. 用装置③制备和收集少量 NH3
D. 用装置④验证FeCl3 对 H2O2分解有催化作用
洗涤含SO2的烟气。以下物质可作洗涤剂的是________。
a.Ca(OH)2 b.Na2CO3
c.CaCl2 d.NaHSO3
在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是 ( )。

A.a反应:Fe2++2H++H2O2===Fe3++2H2O
B.b反应:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C.c反应:H++OH-===H2O
D.d反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
为测定某有机物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成0.3molH2O和0.2 molCO2,消耗氧气6.72L(标准状况下),则该物质的实验式是 。
(2)用质谱仪测定该有机物的相对分子分子质量,得到如图所示的质谱图,则其相对分子质量为
,该物质的分子式是 。
 |
(3)根据价键理论,预测A的可能结构并写出结构简式: 、 。
(4)经测定,有机物A的核磁共振氢谱如下图所示,则A的结构简式为 。
 |
针对下列实验现象表述不正确的是
A.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B.在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D.将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
已知一个SO2分子的质量是a克,一个SO3分子的质量是b克,若以硫1/100作为标准,则SO2的摩尔质量是( ) g/mol
A. 100a/(b—a) B.l00a/(3a-2b) C. l00b/(3a-2b) D.l00a/(3b-2a)
下列电子式中,书写正确的是( )

设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.0.2 molCH4分子所含质子数为2NA
B.24 g金属镁变为镁离子时失去的电子数为NA
C.含有NA 个氦原子的氦气在标准状况下的体积约为11.2L
D.标准状况下,11.2 L CCl4 所含分子数为NA
A. 30g冰醋酸和葡萄糖的混合物中含氢原子的数目为2NA
B. 在12. 0 gNaHSO4晶体中,所含离子数目为0.3NA
C. 足量的镁与浓硫酸充分反应,放出 2.24L混合气体时,转移电子数为0.2NA
D. 标准状况下,11.2L乙烯和丙烯混合物中含氢原子数目为2NA
- 写作。(50分) 事物的变化有时会影响人的心情。例如:生活条件改善了;走出去旅游了;经过自己的努力取得成绩了;懂事了,关
- 公元1世纪,诞生于南亚印度的佛教传入中国内地。佛教作为外来的,与儒、道异质的文化,在经过彼此冲突、相互融合后,于东晋时代
- 阅读下文,完成1——4题。 泪与笑
- 下列方法不能用来淡化海水的是() A.过滤 B.多级闪急蒸馏 C.使海水结冰脱盐 D.膜法淡化海水
- 关于分子间距与分子力的下列说法中,正确的是 ( )A.水和酒精混合后的体积小于原来的体积
- 下面漫画《锤和钉子》告诉我们( )①价值是一事物对主体的积极功能和属性 ②价值是主体需要与事物属性之间的特定关系 ③人
- 下列有关化学用语描述正确的是() A.乙醇的分子式C2H5OH B.硫离子的结构示意图: C.NH4Cl的电子式:
- 20世纪80年代末90年代初东欧社会主义国家发生剧变,这表明() ①国际社会主义运动在全世界遭到失败 ②社会主义
- 某液态烃和溴水发生加成反应生成2,3-二溴-2-甲基丁烷,则该烃是( ) A. 3-甲基-1-丁烯 B. 2-甲基
- 设z的共轭复数为,若z+=4,z·=8,则等于() A.1 B
- 下列关于铷的叙述不正确的是A.金属铷投入水中会引起爆炸B.铷是一种强还原剂,铷离子很稳定C.铷受热后,能在空气中剧烈燃烧
- 父亲正常,母亲患红绿色盲,生了一个性染色体为XXY的不患色盲的儿子。该儿子多出的X染色体来自 A.卵细胞
- (8分)如图,小明家所住楼房的高度米,到对面较高楼房的距离米,当阳光刚好从两楼房的顶部射入时,测得光线与水平线的夹角为.
- 如图6-42所示,劈尖干涉是一种薄膜干涉,其装置如图所示,将一块平板玻璃放置在另一平板玻璃之上,在一端夹入两张纸片,从而
- 物体B放在物体A上,A、B的上下表面均与斜面平行(如图).当两者以相同的初速度靠惯性沿光滑固定斜面C向上做匀减速运动时(
- 对于第能层,若它作为原子的最外层,则容纳的电子数最多与—1层相同,当它作为次外层,则其容纳的电子数比+1层上电子最多能多
- 某村正在进行选举村委会主任的活动。28岁的王某不仅自己要参加投票选举,而且还把自己89岁的奶奶也背来参加投票选举。参加竞
- 下列各项叙述中,仅是哺乳动物具有的特点是( )A.心脏分四个腔,用肺呼吸 B.体温恒定C.能
- 一个足够长的竖直放置的磁铁结构如图所示。在图1中磁铁的两个磁极分别为同心的圆形和圆环形。在两极之间的缝隙中,存在辐射状的
- 国际联盟的总部设在日内瓦,联合国的总部设在纽约,这些事实明 欧洲国家的综合实力下降 ②世界的中心从欧洲向其他地区转移 ③



