高中 化学

【查阅资料】
①BCl3:的熔点为﹣107.3℃,沸点为12.5℃
②2B+6HCl 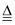 2BCl3+3h2
2BCl3+3h2
③硼与侣的性质相似,也能与氢氧化钠溶液反应
请回答下列题:
-
(1) A装置可用高高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为.
-
(2) 为了完成三氯化硼的制备,装置从左到右的接口连接顺序为.
-
(3) 装里E中的试剂为.如果拆去E装置,可能的后果是.
-
(4) D装置中发生反应前先通入一段时间的氯气,其目的是.该装置中发生反应的化学方程式为.
-
(5) 三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式.
-
(6) 请设计一个简易实验,验证制得的产品中是否含有硼粉.
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )

选项 | 实验方案、现象 | 结论 |
A | 向油脂皂化反应后的溶液中滴加酚酞,溶液变红 | 油脂已经完全皂化 |
B | 将石蜡油(液态石蜡)分解的产物通入溴的四氯化碳溶液中,溶液逐渐褪色 | 分解产物中一定含有乙烯 |
C | 将溴水加入苯中,振荡、静置后分层,水层颜色变浅 | 说明苯与溴发生了加成反应 |
D | 淀粉溶液在稀硫酸存在下水浴加热一段时间后,加入碘水,溶液不变蓝色 | 说明淀粉已水解完全 |
-
(1) 已知:N2(g)+O2(g)=2NO(g) ΔH=akJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=kJ·mol-1。
-
(2) 水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:。该反应需控制温度,温度过高时氨氮去除率降低的原因是。
 图1
图1  图2
图2图3

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是。
-
(3) 电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2 , 工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为mol。

(1)气体A是 , 产生气体B的电极反应是 .
(2)溶液C的溶质是 ,解汞槽中发生反应的化学方程式是 .
(3)该方法中能循环使用的物质是 .(只需写出一种)
(4)氯碱生产常用方法比较见下表:
项目 | 隔膜法 | 离子膜法 | 水银法 |
氢氧化钠的质量分数为50%的烧碱溶液中氯化钠的含量/% | 1.0﹣1.2 | <0.005 | 0.005 |
电解液中NaOH的质量分数/% | 10﹣11 | 32﹣33 | 45﹣50 |
总耗能/(kW•h)•t﹣1(不包含蒸发能耗) | 3260 | 2645 | 3205 |
结合表中数据回答,与离子膜法相比,水银法的优点是 ;水银法也有明显的不足,从生产中所用材料来看主要是 .
 2Q(g)+nR(g),达到平衡后,X的转化率为35%,混合气体的压强却比起始压强小,则方程中n的值是( )
2Q(g)+nR(g),达到平衡后,X的转化率为35%,混合气体的压强却比起始压强小,则方程中n的值是( )
①C(s)+O2(g)═CO2(g);ΔH1 C(s)+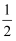 O2(g)═CO(g);ΔH2
O2(g)═CO(g);ΔH2
②S(s)+O2(g)═SO2(g);ΔH3 S(g)+O2(g)═SO2(g);ΔH4
③H2(g)+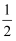 O2(g)═H2O(l);ΔH5 2H2(g)+O2(g)═2H2O(l);ΔH6
O2(g)═H2O(l);ΔH5 2H2(g)+O2(g)═2H2O(l);ΔH6
④CaCO3(s)═CaO(s)+CO2(g);ΔH7 CaO(s)+H2O(l)═Ca(OH)2(s);ΔH8
将饱和FeCl3溶液加入沸水中能制得Fe(OH)3胶体,下列有关说法正确的是
A.溶液和胶体的本质区别是能否发生丁达尔效应
B.含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1 mol
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明,来区别溶液和胶体
下列有关金属元素特征的叙述正确的是
A. 金属元素的原子只有还原性,其阳离子只有氧化性
B. 金属元素的单质在常温下都为固体
C. 含金属元素的离子都是阳离子
D. 金属阳离子被还原不一定得到金属单质
2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是

A.这类巢式硼烷的通式是 CnHn+4
B.2B5H9 + 12O2![]() 5B2O3 十9H2O ,l molB5H9完全燃烧转移25mol电子
5B2O3 十9H2O ,l molB5H9完全燃烧转移25mol电子
C.8 个硼原子的巢式棚烷化学式应为 B8H10
D.硼烷与水反应是非氧化还原反应
下列叙述正确的是( )
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.某元素从化合态变为游离态时,该元素一定被还原
D.还原剂在反应中发生还原反应
25 ℃时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子
Amol·L-1与Bmol·L-1,则A和B关系为( )
A.A>B B. A=10-4 B C.B=10-4 A D.A=B
下列制取Cl2、探究其漂白性,收集并进行尾气处理的原理和装置合理的是( )

已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数:c>d B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ D. 原子半径:X<W
Ⅰ.NaClO2的一种生产工艺如下:

已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO2•3H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2 分解成NaClO3 和NaCl。
(1)写出“反应”步骤中的还原产物:__________。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:____
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:___________
(4)“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③______;④38℃~60℃干燥,得到产品。
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_________。
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是_______mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:

在步骤(3)过程中,溶液又呈蓝色,其原因是_________。
- If youlive in the United States, the law says you can't have
- 下列不是温室效应形成原因的是() A. 煤和石油的大量燃烧 B. 生物圈中的碳循环平衡被打破
- 将相同状态的铁和镁分别与相同质量分数,足量的稀盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列说法正确的是() A
- 单项选择 Sheis always willing to share things with others. So sh
- Niki isalways full of ideas,but isuseful to my knowle
- 妈妈在蒸馒头时,开锅后改用“小火”。针对这种做法,下列说法中正确的是( )A.水沸腾后,改用“小火”能更快的
- 请看漫画,漫画中这位少女的心思启示我们的是( ) ①每个人都是独特的,找不到第二个完
- 关于中华人民共和国成立的说法,下列不正确的是 ( ) A.实现了民族的解放和国家的独立 B.是中国领导全国人民经过
- 近年来,很多外国电影中出现了中国元素,其中,今年上映的《地心引力》这部电影中出现了“天宫一号”和“神舟”飞船等中国元素。
- 化学无处不在,下列与化学有关的说法不正确的是 A.侯氏制碱法的工艺过程中应用了物质溶解度的差异 B.可用蘸浓盐酸的棉棒检
- 现要测量某小量程电流表的内阻,其内阻在5Ω~8Ω之间,可选用的器材如下: A.待测电流表A(量程10mA) B.电压
- A、B两种固体物质的溶解度曲线如右图所示.据图回答下列问题: (1)图中A、B两物质的溶解度相等时,对应的温度是_℃.
- 下列各句中“若”的意义和用法不同的一项是【 】 A、若先王之报怨雪耻 B、爱以身为天下,若可以托天下 C、必有忍也,若
- 下列属于我国内海的是( ) A.渤海、黄海 B.黄海、东海 C.琼洲海峡、台湾海峡 D.渤海、琼州海
- There is a shop near my home .Thepeople in the shop are frie
- These measures are a at reducing unemployment by 5
- (08年长郡中学一模文)双曲线x2-y2=4的两条渐近线和直线x=2围成一个三角形区域(含边界),则该区域可表示为(
- 分解因式:=____________。
- 阅读图文材料,完成下列要求。 淡水珍珠是指江河、湖泊、池塘等水体中产出的珍珠。浙江省诸暨市是我国淡水珍珠养殖、加工和销售
- (2分)如果衰变时产生的新核处于激发态,将会辐射出 。



