高中 化学
 H+ + Cl-+HClO
B . CaCO3加入醋酸中:CO
H+ + Cl-+HClO
B . CaCO3加入醋酸中:CO  + 2H+ = CO2↑ + H2O
C . 用惰性电极电解MgCl2溶液:2Cl-+2H2O
+ 2H+ = CO2↑ + H2O
C . 用惰性电极电解MgCl2溶液:2Cl-+2H2O  H2↑+ Cl2↑ +2OH-
D . 酸性KMnO4溶液滴入FeSO4溶液中:MnO4-+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
H2↑+ Cl2↑ +2OH-
D . 酸性KMnO4溶液滴入FeSO4溶液中:MnO4-+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
-
(1) 写出NaHSO4在水中的电离方程式。
-
(2) 粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,要除去这些杂质,可选用以下试剂:①Na2CO3、②NaOH、③BaCl2、④HCl ,则试剂加入的先后顺序是(填序号)。
-
(3) 2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O,用双线桥法标出该反应电子转移的方向和数目;若有0.1mol电子转移时生成Cl2的体积为(标准状况),被氧化的HCl的物质的量为。
-
(4) 某无色透明溶液可能含有K+、Cu2+、Ca2+、SO42-、CO32-、Cl﹣中的几种,现进行如下实验:
①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解。
③向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:该溶液中肯定有,肯定没有,可能有(填离子符号)。
 、
、 、
、 、
、 、
、 , 向其中加入足量的
, 向其中加入足量的 固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
 B .
B .  、
、 C .
C .  D .
D . 

已知:①“净化除杂”时采用真空蒸馏的方法提纯硒(沸点为685℃);
②焙烧后,Cu、Ag均以硫酸盐形式存在,  ;
;
③“浸出液”中溶质的饱和浓度不小于0.01  。
。
下列说法错误的是( )
 表示阿伏加德罗常数的值,下列叙述中正确的是( )
表示阿伏加德罗常数的值,下列叙述中正确的是( )
 混合气体中的碳原子数为
混合气体中的碳原子数为 B . 标准状况下,11.2L的乙醇所含的氢原子数等于3
B . 标准状况下,11.2L的乙醇所含的氢原子数等于3 C .
C .  与足量水反应转移的电子数为0.1
与足量水反应转移的电子数为0.1 D .
D .  溶液中含有
溶液中含有 的数目为0.1
的数目为0.1
-
(1) 中和滴定是重要的定量实验,实验成功的关键是准确读数和终点判断。
①如图I表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为5,量筒中液体的体积是 mL。
②如图 II表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体体积为(填代号)。
A.a mL B.大于a mL C.等于(50-a) mL D.大于(50-a) mL

-
(2) 某研究性学习小组用0.2000 mol·L-1 NaOH标准溶液滴定20.00 mL 醋酸溶液的浓度,实验数据记录如下:
实验序号
1
2
3
4
消耗NaOH溶液的体积
20.07
20.02
18.80
19.97
①计算醋酸溶液的浓度 保留四位有效数字 。
②关于该滴定实验,从下列选项中选出最恰当的一项 选填字母。
锥形瓶中溶液
滴定管中溶液
选用指示剂
选用滴定管
A
碱
酸
石蕊
乙
B
酸
碱
甲基橙
甲
C
酸
碱
酚酞
乙
D
碱
酸
酚酞
甲
-
(3) 浓度影响弱酸、弱碱的电离程度。用pH计测定时不同浓度的醋酸的pH,结果如表:
醋酸浓度
0.0010
0.0100
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.73
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是。
②从表中的数据,还可以得出另一结论:随着醋酸浓度的增大,醋酸的电离程度将填“增大”“减小”或“不变”。
-
(4) 多元弱酸分步电离,以第一步电离为主,即电离常数Ka1>Ka2。
向0.10
 二元弱酸H2A溶液逐滴滴入NaOH溶液,溶液中的H2A、HA-、A2-的物质的量分数
二元弱酸H2A溶液逐滴滴入NaOH溶液,溶液中的H2A、HA-、A2-的物质的量分数  随pH的变化如图所示[已知
随pH的变化如图所示[已知  ]。则Ka1: Ka2=。
]。则Ka1: Ka2=。
-
(5) 温度影响弱酸、弱碱的电离。以醋酸为例,设计如下实验方案进行验证:用pH计或精密pH试纸测定相同浓度的醋酸在不同的pH。
A:NH4HCO3 B:NH4NO3 C:CO(NH2)2 D:CH3COONH4 E:CO2 F:CS2 G:CaCO3 H:KSCN I:NaCN J:CH3COOH.
①  ②
②  ③
③ 

已知:

回答下列问题:
-
(1) A中所含官能团的名称是,检验该分子中官能团的常用试剂是.
-
(2) A与C含有相同的官能团,B生成C的反应类型是.
-
(3) C生成D的化学方程式是.
-
(4) 试剂a是.
-
(5) 下列说法正确的是.
a.E能发生取代反应、氧化反应和消去反应 b.M与K是同系物 c.1mol K能跟2molNaOH发生反应
-
(6) G的结构简式是.
-
(7) 在一定条件下E还能跟COCl2发生聚合反应生成高分子化合物,该反应的化学方程式是.
-
(8) G的同分异构体P,分子中含有“
 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2 . 则P的结构简式是.
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2 . 则P的结构简式是.
 C . 检验溶液中的Na+:取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,若火焰呈黄色,则含有Na+
D . 配制100 mL 0.1 mol·L−1氯化钠溶液:称取0.585 g氯化钠固体,放入100 mL容量瓶中,加水定容至刻度线
C . 检验溶液中的Na+:取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,若火焰呈黄色,则含有Na+
D . 配制100 mL 0.1 mol·L−1氯化钠溶液:称取0.585 g氯化钠固体,放入100 mL容量瓶中,加水定容至刻度线
某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )

A. 加入AgNO3可以使溶液由c点变到d点
B. 加入NaCl固体则AgCl的溶解度减小,Ksp也减小
C. 蒸发溶液可以实现b点到a点的转化
D. 图中d点对应的是过饱和溶液
C1SO3H称为氯磺酸,是一种强酸。对于反应:
ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是 ( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
—定条件下,a、b、c、d四种物质在密闭容器中发生反应,测得反应前后各物质的质量如下表所示。下列有关说法中不正确的是
| 物质 | a | b | c | d |
| 反应前的质量/g | 30 | 20 | 10 | 15 |
| 反应后的质量/g | x | y | 0 | 10 |
A.参加反应的c与d的质量比为2∶1 B.x+y=65
C.当y≤20时,该反应一定是化合反应 D.x的取值范围:0≤x≤30
下列叙述正确的是( )
A.固体氯化钠不导电,所以氯化钠不是电解质
B.虽然NaHSO4溶于水能电离出H+,但它不是酸
C.“纳米材料”是粒子直径1~100 nm的材料,它属于胶体
D.在一个氧化还原![]() 反应中,有一种元素被氧化肯定有另一种元素被还原
反应中,有一种元素被氧化肯定有另一种元素被还原
下列有关物质用途说法不正确的是
A . NH 3 可用于生产氮肥 B .浓 HNO 3 可用于生产炸药
C . SO 2 可用于生产硫酸 D .稀 H 2 SO 4 可用于作干燥剂
下列反应中属于氧化还原反应的是
A.Cu2(OH)2CO3![]() 2CuO+H2O+CO2 B.Na2O+H2O = 2NaOH
2CuO+H2O+CO2 B.Na2O+H2O = 2NaOH
C.2CO+O2![]() 2CO2 D.Na2CO3+CaCl2 = CaCO3 +2NaCl
2CO2 D.Na2CO3+CaCl2 = CaCO3 +2NaCl
往甲、乙、丙、丁四个烧杯内分别放入0.1 mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶液中溶质的质量分数大小顺序是( )
A.丁<甲<乙=丙B.丁<甲<乙<丙C.甲=丁<乙=丙 D.甲<乙<丙<丁
已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.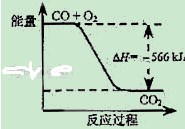 如图可表示由CO生成CO2的反应过程和能量关系
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
反应4NH3+5O2![]() 4NO+6H2O在10 L密闭容器中进行,半分钟后水蒸气的物质的量增加了0.45mol,则此反应的平均反应速率v(X)可表示为( )
4NO+6H2O在10 L密闭容器中进行,半分钟后水蒸气的物质的量增加了0.45mol,则此反应的平均反应速率v(X)可表示为( )
A. v(NH3)=0.002mol/(L·s) B. v(O2)=0.001mol/(L·s)
C. v(NO)=0.001mol/(L·s) D. v(H2O)=0.001mol/(L·s)
- (2020·江州模拟)广西北部湾拥有丰富的海洋资源。 (1)食用海鱼、海虾等海鲜可为人体提供的营养素主要是____
- 如图7所示,电源电压U 保持不变,在甲、乙两处都接入电压表,闭合开关S,测得U甲:U乙=1:3; 断开开关S,拆去电压
- 25 ℃和101 kPa时,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度
- 在春节联欢晚会等舞台上人工制造云雾缭绕的方法是A.燃烧白磷 B.燃烧镁粉C.释放干
- to travel by boat on a hot summer night! A.So pleasant
- (02粤豫桂卷)将两个枝条分别置于营养液中。其中一枝仅保留一张叶片(甲),另一枝保留两张叶片(乙、丙),叶片置玻璃盒中密
- 人体神经细胞与肝细胞的形态结构和功能不同,原因是这两种细胞的 A.DNA碱基排列顺序不同
- 下列做法中,不正确的是A.用燃烧法识别羊毛和合成纤维 B.用甲醛溶液浸泡海产品进行保鲜C.保护金属资源的有效途径之一是将
- (6分)化简
- 读“某地2009年1月7日和6月9日气温(曲线)和降水(柱状)日变化图”,读图回答:关于该地6月9日天气的叙述,正确的是
- 为了促进区域经济更加协调发展,国家在我国多个地区实行经济区跨越式发展改革。上海浦东新区、武汉城市圈、成渝试验区是我国三个
- 空气是一种宝贵资源。下列有关空气的说法正确的是A.空气中含量最多的是氧气B.空气质量报告中所列的空气质量级别数目越大,空
- “早穿皮袄午穿纱,围着火炉吃西瓜.”这句谚语反映了我国新疆的某些地区夏季昼夜气温变化显著.沿海地区不像内陆地区昼夜气温变
- When I was at college I ______ three foreign languages, but
- (2013年四川高考6题)图1是一幅题为《日本的泥脚》(1938年)的漫画。导致画中情形的重要因素有( )①
- 关于受精过程的叙述错误的是 A.获能后的精子与卵子相遇后,释放顶体酶穿过透明带进入放射冠 B.透明带反应是防止多精入卵的
- 下列说法正确的是 ( ) A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 B.NH4HCO3
- 中共中央要求所有领导干部和全体党员继续把人民对我们党的“考试”、把我们党正在经受和将要经受各种考验的“考试”考好,努力交
- 1911年著名物理学家卢瑟福在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:①大多数α粒子能穿透金箔
- 和是两个相同的波源,这两个波源形成的波发生干涉时,在干涉区域有a、b、c三点,某时刻a点有波峰与波谷相遇,b点有两列波的



