高中 化学
 制取、收集、吸收,以及
制取、收集、吸收,以及  的还原性探究进行了如下实验设计。
的还原性探究进行了如下实验设计。
-
(1) Ⅰ.
 的收集和吸收
的收集和吸收 若用图甲装置,排空气法收集
 ,气体应从口进入(选填“m”或“n”)。
,气体应从口进入(选填“m”或“n”)。 -
(2) 已知
 难溶于
难溶于  。图乙、丙、丁、戊四种装置中,不能用来吸收
。图乙、丙、丁、戊四种装置中,不能用来吸收  的是。
的是。 
-
(3) Ⅱ.
 的还原性探究
的还原性探究 利用下列装置,进行
 还原
还原  的反应。
的反应。
已知:
 与
与  反应的生成物为
反应的生成物为  、
、  和无毒气体X,且X不被浓硫酸和碱石灰吸收。
和无毒气体X,且X不被浓硫酸和碱石灰吸收。采用上图A所示装置作为
 的发生装置,写出该反应的化学方程式。
的发生装置,写出该反应的化学方程式。 -
(4) 按气流方向正确的装置连接顺序为A→→→→→C(填序号,每个装置只用一次)。装置连接后,首先应进行的操作是。
-
(5) 实验结束时,应首先_______(填序号)。A . 熄灭A装置的酒精灯 B . 熄灭B装置的酒精灯
-
(6) 若称取
 完全反应后,测得生成气体X的体积为
完全反应后,测得生成气体X的体积为  (已折算为标准状况),通过计算推测Ⅹ的化学式为。
(已折算为标准状况),通过计算推测Ⅹ的化学式为。
-
(7) 装置B中
 与
与  反应的化学方程式为。
反应的化学方程式为。
| H-H | Cl-Cl | H-Cl | |
| 键能(kJ/mol) | 436 | 243 | a |
下列有关H2(g)与Cl2(g)反应生成HCl(g)的说法正确的是( )

-
(1) X的转化率是
-
(2) 由图中所给数据进行分析,该反应的化学方程式为;
-
(3) 反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=,
-
(4) 下列选项中,能判断该反应达平衡状态的是 .A . 消耗3molX的同时,消耗1molY B . X、Y、Z三种物质的浓度不再发生变化 C . 生成1molY的同时,生成2molZ D . X的物质的量不再发生变化.


-
(1) 用一个离子反应方程式说明
 和
和  结合
结合 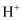 能力的相对强弱。
能力的相对强弱。
-
(2) 冰的密度比水的密度小,能浮在水面上。主要原因是。
-
(3) 用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体
 。
。
 CO(g)+Cl2(g)∆H>0。当反应达到平衡时,下列措施不能提高COCl2转化率的是( )
CO(g)+Cl2(g)∆H>0。当反应达到平衡时,下列措施不能提高COCl2转化率的是( )
 Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( ) 

洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。
漂白粉是常用的消毒剂。
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
____________________________________________________
(2)漂白粉的有效成分是(填化式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)= 1.8×10-10,Ksp(AgY)= 1.0×10-12,Ksp(AgZ)= 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中c(Y-)= mol/L
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
② 在上述(3)的体系中,能否实现AgY向AgX的转化?
请通过计算,简述能否实现转化的理由是:
 若用上述装置探究氨气的还原性,将装置C替换为右图,从d中同时通入
若用上述装置探究氨气的还原性,将装置C替换为右图,从d中同时通入
纯净干燥的氯气,发生反应:8NH3 + 3Cl2 → 6NH4Cl + N2。
写出装置C中的现象(至少两点)________________________________
检验产物NH4Cl中NH4![]() +的方法是________________________________。
+的方法是________________________________。
根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。[来源:学科网ZXXK][来源:学#科#网]
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
有机物A为烃的含氧衍生物,其中含C占55.8%,H占7%,其它为氧,且A分子的所有C原子在同一条直线上,D为二溴代烃。有如下转变过程:其中

❶B,D分子均达饱和,❷F为五元环状分子,有2种环境不同氢,❸一个碳上不能连两个羟基。请回答:
(1)A,F结构简式分别为_______________________,_______________________,
(2)B→D的反应类型_______________________,
(3)1molB的同分异构体中能与足量的Na反应,产生1mol气体还有_________种(除B外)
(4)写出D→C的化学反应方程式________________________________________,
C→E的化学反应方程式__________________________________________,
在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显__________(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=______________________________________________________。
)=c(Cl-),则溶液显__________(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=______________________________________________________。
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:( )

除去某溶液里溶解的少量杂质,下列做法中不正确的是(括号内的物质为杂质)
A.NaCl溶液(CaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热
B.KNO3溶液(KCl):加过量AgNO3溶液,过滤
C.NaCl溶液(Br2):加汽油,分液
D.KNO3溶液(NaCl):加热蒸发得浓溶液后,降温,过滤
A. 丙的简单氢化物分子内存在氢键
B. 由甲、乙两元素组成的化合物中,只含有极性键
C. 由甲和丙两元素组成的分子不止一种
D. 乙和丁两元素的最高价氧化物的水化物之间能发生反应
- 从边长为1的等边三角形内一点分别向三边作垂线,则三条垂线段长的和为 ( ) A. B.2
- 在吴越争霸的过程中,越国被吴国打败。越王勾践的对策是( )A.坚持战斗、继续抵抗
- 用反证法证明命题“在一个三角形中,至少有一个内角不小于60°”,假设为 ------------
- A good idea ______me! Which of the following is Not Right?
- 25.依据下列的示例仿写,要求句式、结构与示例相似,不得选择已经出现过的地名作为描述对象。 【示例】 撷一朵日尔曼的白云
- 古诗文填空(6分) ①_______________,各领风骚数百年。 ②必先苦其心志,劳其筋骨,饿其体肤,空乏其身,
- 已知函数:,其中:,记函数满足条件:为事件为A,则事件A发生的概率为( ) A. B.
- 已知(石墨) = (金刚石),在该反应进程中其能量变化如图所示,有关该反应的描述正确的是( ) A、该反应为放热反
- 将一小块固体钠在空气中加热片刻,然后将固体投入足量的水中,产生V mL(标准状况下)气体,向余下的溶液中加入10 mL
- 水是生命之源,我们应该了解水、爱护水资源。下列说法错误的是 A.为使水中的悬浮杂质沉降,可在水中加人适量的明矾 B.自来
- 2009年大学开学之际,又一批贫困学生得到银行的资助。商业银行对贫困生的资助属于 A.保险业务 B.结算业务 C.贷款业
- ......
- 下列现象不属于条件反射活动的是( ) A. 谈虎色变 B. 一次遭蛇咬,十年怕井绳 C. 寒冷使皮肤上出现“鸡皮
- David invited some classmates to cometo his party, but ____
- 从某小学随机抽取名同学,将他们的身高(单位:厘米)数据绘制成频率分布直方图由图中数据可知身高在内的学生人数为( )
- 铝与镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界,镓常以极少量分散于铝(如Al2O3)中。用NaOH溶解
- 在配合物[Co(NH3)5Cl]Cl2中,内界和配位数分别是( ) A.Co(NH3)5、5
- 选择填空从每题A、B、C、D四个选项中,选出一个最佳答案 —What ________ do you like? —I
- 如图所示,带箭头的直线是某一电场中的一条电场线,在这条线上有A、B两点,用、表示A、B两处的场强,则( )A.A、B两
- 阅读下面的文字,完成后面题目。 世 界 夏阳 一个春雨飘摇的夜晚,他——一个小说家——坐在一家饭馆里,望着远处的那两男一



