高中 化学
-
(1) G2+基态核外电子排布式为。
-
(2) Y、Z、W三种元素的第一电离能由大到小的顺序为(填元素符号)。
-
(3) KW2的空间构型为(用文字描述)。
-
(4) K和W的简单氢化物沸点相差较大,原因是。
-
(5) 1 mol Y2X4分子中含有σ键数目为 ;其中 Y 原子原子轨道的杂化类型是 。
-
(6) Z、G形成的一种化合物的晶胞结构如图所示,该物质的化学式为 ,与每个G原子紧邻的G原子的有个

在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H=akJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=akJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
-
(1) 基态Co的价层电子排布式是3d74s2 , 轨道表示式是
 。在元素周期表中,该元素属于(填“d”或“ds”)区。
。在元素周期表中,该元素属于(填“d”或“ds”)区。
-
(2) [Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈形,是(填“极性”或“非极性”)分子。
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个和3个。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,(补全实验操作和数据)。
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
-
(3) 钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、(填字母序号)。
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=。
 B .
B .  C .
C .  D .
D . 


 和
和 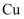 )几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
-
(1)
 和
和  中阳离子基态核外电子排布式为,
中阳离子基态核外电子排布式为,  三种元素的第一电离能由大到小为;
三种元素的第一电离能由大到小为;
-
(2) 以
 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备  。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为,推测抗坏血酸在水中的溶解性:(填“难溶于水”或“易溶于水”),一个
。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为,推测抗坏血酸在水中的溶解性:(填“难溶于水”或“易溶于水”),一个  晶胞(见图2)中,
晶胞(见图2)中, 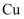 原子的数目为;
原子的数目为; 
-
(3)
 和
和  等配体都能与
等配体都能与  形成配离子。
形成配离子。  含
含  键,中心离子的配位数为;
键,中心离子的配位数为;
-
(4)
 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知  的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。 
①磷化铝的晶体类型为,
②A、B点的原子坐标如图所示,则C点的原子坐标为,
③磷化铝的晶胞参数
 ,其密度为
,其密度为  (列出计算式即可,用
(列出计算式即可,用  表示阿伏加德罗常数的值);
表示阿伏加德罗常数的值); -
(5)
 具有对称的立体构型,
具有对称的立体构型,  中的两个
中的两个  被两个
被两个  取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则  的空间构型为。
的空间构型为。
用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是( )1.
A.AgNO3 B.Na2SO4 C.CuCl2 D.H2SO4
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式____________________。
(2)右图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示
 意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。
意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。
若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________、
________(填“增大”、“减小”或“不变”);该反应放出的热量为 kJ。
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,
则ΔH 0 (填“大于”、“ 小于”或“大于或小于都可”)。
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。

已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序是a→ → → →b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是 。
(2)灼烧固体A制Na2CO3在 (填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3使pH降低,反应的离子方程式为 。
(3)下图装置中常用于实验室制备CO2的是 (填字母编号);用b装置制备NH3,分液漏斗中盛放的试剂是 (填试剂名称),烧瓶内可加入的固体试剂是 (填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。(仪器自选)请把实验方案填全:
供选择的试剂:1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g天然碱晶体样品,溶于适量蒸馏水中。
② 。
③ 。
④计算天然碱晶体中含Na2CO3的质量分数。
![]() 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品;![]() 在分析试剂、医药、电子工业中用途广泛请回答下列问题:
在分析试剂、医药、电子工业中用途广泛请回答下列问题:

![]() 可作净水剂,其原理是 ______用必要的化学用语和相关文字说明.
可作净水剂,其原理是 ______用必要的化学用语和相关文字说明.
![]() 相同条件下,
相同条件下,![]() 的
的![]() 中
中![]() ______填“等于”、“大于”或“小于”
______填“等于”、“大于”或“小于”![]() 中
中![]()
![]() 均为
均为![]() 的几种电解质溶液的pH随温度变化的曲线如图1所示.
的几种电解质溶液的pH随温度变化的曲线如图1所示.
![]() 其中符合
其中符合![]()
![]() 的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
![]() 时,
时,![]() 的
的![]()
![]() 中
中![]() ___ mol/L
___ mol/L
![]() 室温时,向100mL
室温时,向100mL ![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示:
溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
已知X、Y、Z是阳离子,K是阴离子,M、N是分子,它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞溶液,溶液变红;
③Y和K都由A、B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀J生成,再加入过量的含K或Y的溶液,沉淀J消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为 。
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式:
。
(4)从电离的角度看白色沉淀J能溶于过量的含K或Y的溶液,其原因是(用离子方程式表示):
。
(5)上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1 mol·L-1的NaOH溶液,出现了如图中a、b、c三个阶段的图像,①写出b阶段的离子方程式:
。
②根据图像判断该盐的化学式为 。

化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO![]() 还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
①N2的结构式为___________________________________________________。
②上述反应离子方程式为___________________________________________,
其平均反应速率v(NO![]() )为________mol·L-1·min-1。
)为________mol·L-1·min-1。
③还原过程中可生成中间产物NO![]() ,写出3种促进NO
,写出3种促进NO![]() 水解的方法______________。
水解的方法______________。
 (2)电化学降解NO
(2)电化学降解NO![]() 的原理如右图所示。
的原理如右图所示。
①电源正极为________(填“A”或“B”),阴极反应式为____________________________。
②若电解过程转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为______g。
X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | ﹣4,+4 | ﹣2 | ﹣1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在元素周期表中的位置是 第三周期 ;R在自然界中有两种质量数不同的核素,它们之间的关系互为 .
(2)Z的单质与水反应的离子方程式是 .
(3)Y与R相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价 d.沸点XR>YX4
(4)根据表中数据推测,Y的原子半径的最小范围是 .
(5)X、M、R形成的能够杀菌、消毒物质的结构式为 .
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是 .
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是:( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y元素的非金属性比W元素的非金属性强
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y、Z的阴离子电子层结构都与R原子的相同
- 最近几年越来越多的大学生加入打工的队伍,请你结合下表,就这一现象写一篇短文。 现象 1.根据最近调查,约25%的大学生打
- ―Is ________ finished?―Not yet. My dirty clothes are still s
- 23.检测一个标称值为5Ω的滑动变阻器。可供使用的器材如下: A.待测滑动变阻器Rx,全电阻约5Ω(电阻丝绕制紧密,匝数
- 阅读下面的文言文,完成8--10题。 乐恢字伯奇,京兆长陵人也。父亲,为县吏,得罪于令,收将杀之。恢年十一,常俯伏
- 胚胎干细胞在形态上表现为 ( ) A.体积大,细胞核大,核仁明显;
- 南北朝时期,促进了北方民族大融合的重要事件是:( ) A.商鞅变法 B.北魏孝文帝改革 C
- 下列叙述正确的是( ) A.Li在氧气中燃烧主要生成 B.将SO2通入溶液可生成沉淀 C.将CO2通入次氯酸钙溶液可生
- 关于减数分裂的描述,正确的是 A.第一次分裂,着丝点分裂,同源染色体不配对 B.第一次分裂,着丝点不分裂,同源染色体配对
- 飞机着陆后以6m/s2大小的加速度做匀减速直线运动,其着陆速度为60m/s,求: (1)它着陆后12s内滑行的位移s (
- ---_____my alarm clock? ---_____on the bed. A. Where,It
- 下列河流中,不注入北冰洋的是( ) A.鄂毕河 B.伏尔加河 C.
- Recently I was asked,“Are we anywhere near the day when y
- 下表为元素周期表中某一周期元素的原子结构示意图.元素 名称 钠 镁 铝 硅 磷 硫 氯 氩 元素 符号 Na Mg Si
- 下列说法正确的是( )A.增大压强,活化分子百分数增大,化学反应速率一定增大B.升高温度,活化分子百分数增大,化学反
- ......
- 2009年6月3日美国通用汽车公司与中国四川民营企业腾中重工机械有限公司共同宣布,已经就战略收购悍马达成谅解备忘录。这是
- 以下培育原理相同的一组是 A.太空椒和抗虫棉 B.无子番茄和“番茄-马铃薯”
- 设抛物线y2=4px的焦点弦的两端点为(x1,y1)、(x2,y2),则y1y2的值是()A.p2B.1-p2C.4p
- 完形填空(共20小题;每小题1.5分,满分30分) 请阅读下面短文,掌握其大意,然后从36~55各题所给的四个选项(A、
- 证明不等式:1+++…+<2(n∈N*).



