高中 化学

 各成分的物质的量变化,
各成分的物质的量变化,  时刻改变的条件可能是缩小容器体积
C . 图Ⅲ表示某明矾溶液中加入
时刻改变的条件可能是缩小容器体积
C . 图Ⅲ表示某明矾溶液中加入  溶液,沉淀的质量与加入
溶液,沉淀的质量与加入  溶液体积的关系,在加入
溶液体积的关系,在加入  溶液时铝离子恰好沉淀完全
D . 电导率可表示溶液导电性的强弱,电导率越大导电性越强,图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系
溶液时铝离子恰好沉淀完全
D . 电导率可表示溶液导电性的强弱,电导率越大导电性越强,图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系
①淀粉②纤维素③氨基酸④油脂⑤蔗糖⑥酚醛树脂⑦聚乙烯⑧蛋白质.
-
(1) 完成本实验时,下列仪器中一定不需要的是(填字母,下同)。

-
(2) 通过计算可知,需天平称量NaOH固体的质量为g。
-
(3) 配制过程一般可分为以下几个步骤:①称量、②计算、③溶解、④摇匀、⑤转移、⑥洗涤、⑦定
容、⑧振荡、⑨装瓶贴签,正确的操作顺序为(填序号)。小明认为还缺少一个步骤,此步骤的名称是。
-
(4) 实验结束后,发现所配溶液浓度偏大,可能的原因是________(填代号)。A . 所用NaOH已潮解 B . 定容时俯视观察液面 C . 未洗涤烧杯 D . 称量时砝码与NaOH的位置颠倒
 是空气的主要成分之一,
是空气的主要成分之一, 作为原料广泛用于合成氨工业、硝酸工业等。工业上用氨催化氧化生产硝酸,在转化器中发生反应的热化学方程式为
作为原料广泛用于合成氨工业、硝酸工业等。工业上用氨催化氧化生产硝酸,在转化器中发生反应的热化学方程式为
 。生产硝酸的尾气中主要含有
。生产硝酸的尾气中主要含有 、
、 等大气污染物,可将其转化成
等大气污染物,可将其转化成 、
、 、
、 等而除去。下列有关
等而除去。下列有关 、
、 和
和 的说法正确的是( )
的说法正确的是( )
 的键角大于
的键角大于 的键角
B .
的键角
B .  的空间构型为直线形
C .
的空间构型为直线形
C .  中的
中的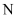 原子杂化类型为
原子杂化类型为 D .
D .  作配体是因为
作配体是因为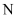 原子存在空轨道
原子存在空轨道

请回答下列问题:
-
(1) 请写出海水淡化的两种方法:、 。
-
(2) 通入热空气吹出Br2 , 利用了Br2的 (填序号)。
a.氧化性
b.还原性
c.挥发性
-
(3) 操作Ⅰ用SO2水溶液吸收Br2 , 有关反应的离子方程式为。
-
(4) 写出操作Ⅱ通氯气后发生的离子方程式。
-
(5) 为使母液中的MgCl2转化为Mg(OH)2 , 从原料来源及经济效益角度考虑, 试剂①最好选用 。
a.氨水
b.氢氧化钙
c.氢氧化钠
-
(6) 操作Ⅲ的化学方程式为 。
实验 | 现象 |
| 一段时间后,培养皿中由铜珠向外侧依次呈现: Ⅰ区澄清且紫色褪色明显 Ⅱ区底部覆盖棕黑色固体 Ⅲ区澄清且紫色变浅 |
已知:MnO2是棕黑色固体。下列说法不正确的是( )
 +16H+=5Cu2++2Mn2++8H2O
B . Ⅱ区棕黑色固体是由铜和酸性高锰酸钾反应产生还原产物
C . Ⅲ区紫色变浅说明在Ⅲ区MnO
+16H+=5Cu2++2Mn2++8H2O
B . Ⅱ区棕黑色固体是由铜和酸性高锰酸钾反应产生还原产物
C . Ⅲ区紫色变浅说明在Ⅲ区MnO 的浓度减小,是因为离子扩散作用
D . 如果酸性高锰酸钾过量很多,所有反应完全后,产物中可能没有Mn2+
的浓度减小,是因为离子扩散作用
D . 如果酸性高锰酸钾过量很多,所有反应完全后,产物中可能没有Mn2+
 磁流体的说法错误的是( )
磁流体的说法错误的是( )
 磁流体分散系属于溶液
B . 纳米
磁流体分散系属于溶液
B . 纳米  磁流体中分散质粒子可以透过滤纸
C . 当一束可见光通过该磁流体时会出现光亮的“通路”
D . 纳米
磁流体中分散质粒子可以透过滤纸
C . 当一束可见光通过该磁流体时会出现光亮的“通路”
D . 纳米  磁流体是介稳体系
磁流体是介稳体系
-
(1) A元素的简单离子基态时的电子排布式为 R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
-
(2) CB3分子的空间构型是 ,其中心原子的杂化类型是
-
(3) 由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含 个δ键.
-
(4) E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池.则该燃料电池的负极反应为 正极反应为
-
(5) 1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量.则1molE与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为Y KJ/mol)

亚硝酰氯(NOCl)是有机物合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。某研究性学习小组拟在实验室通风橱中制取亚硝酰氯,先查得如下资料:
①
| 分子式 | 别名 | 熔点 | 沸点 | 溶解性 | 性状 |
| NOCl | 氧化亚硝酰 | ―64.5℃ | ―5.5℃ | 溶于浓硫酸 | 红褐色液体或黄色有毒气体,具有刺激恶臭。遇水生成氮的氧化物与氯化氢 |
②2NO2+2NaOH=NaNO3+NaNO2+H2O
随后他们拟定了如下合成装置示意图

试回答下列问题:
(1)写出制NO的离子方程式 ,装置应选 (从下图乙、丙中选),该装置在使用前,怎样检验其气密性(只有蒸馏水,不能再添加其他仪器或用品) 。

(2)画出净化装置I的装置图并标明所用试剂 。
(3)无水氯化钙的作用是 ;写出氯化亚硝酰与水反应的化学方程式 。
(4)在E装置中能看到的现象 。
(5)指导老师认为装置G不能有效除去有毒气体,写出你的见解和改进措施
某有机物分子中有 n 个CH 2 , m 个 ![]() ,a个CH 3 ,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3 ,其余为OH,则该物质分子中OH的个数可能为( )
A.m-a B.n+m+a C.m+1-a D.m+2-a
下列仪器使用正确的是( )。
A.在表面皿蒸发浓缩NaCl溶液 B.用带玻璃塞的试剂瓶盛盐酸
C.使用漏斗、滤纸、玻璃棒等进行过滤实验
D.配制100mL浓度为0.10 mol·L-1 NaCl溶液时,在容量瓶中溶解、定容
进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
A.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含有SO42-
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口,说明此位置指示的是被蒸馏出物质的沸点
C.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
D.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸
取含有 0.02mol 的硫酸溶液,先投入 0.24g 镁粉,再滴入NaOH 溶液,当使溶液中的镁离子全部转化为沉淀时,需要NaOH的物质的量为(![]() )
)
A.0.02mol B.0.03mol C.0.04mol D.0.01mol
用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,0.01mol Na2CO3含有的Na+离子数为 0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为 22.4L
D.物质的量浓度为 0.5mol/L 的 MgCl2溶液中,含有Cl﹣ 个数为NA
- 下列关于生物种群出生率和人口出生率的叙述,不正确的是 ( ) A.生
- 白细胞介素是一类淋巴因子。研究人员将人白细胞介素的基因导入到酵母细胞中,使其分泌出有活性人白细胞介素。 (1)在体液
- 王湾的《次北固山下》中有一个对偶句,蕴含新事物孕育于旧事物解体之时的哲理,表现时序变迁、新旧交替这一自然规律的诗句是:
- 在光滑水平面上AB两点分别放置质量为m和2m两个点电荷和,两电荷同时由静止释放,已知刚释放时的加速度为a,一段时间后的加
- 假设你是李华,寒假期间你准备和家人去香港迪斯尼乐园游玩。你想了解有关订票方面的具体情况。例如:可否网上订票?团体订票是否
- 已知,则=_________。
- 钓鱼岛群岛自古以来就是中国领土,其附近海域是渔民祖祖辈辈传统的谋生渔场。9月16日12时休渔结束,我国派出海监编队到钓鱼
- 你的家长或老师可能经常和你谈学习问题。请你叙述一次你的家长或老师对你谈学习的情景、内容以及你的感想。要求:1) 不使用真
- 世界上海陆比例是 A.各占1/2
- 已知:如图,把矩形放置于直角坐标系中,,,取的中点,连结,把沿轴的负方向平移的长度后得到. (1)试直接写出点的坐标;
- 呼尔而与之,行道之人弗受;______,______。(《孟子·鱼我所欲也》)
- 太平洋岛国所罗门群岛(见图)当地时间2007年4月2日7时19分(北京时间4月2日4时39分),发生里氏8级强烈地震,所
- 科学思维和科学方法是我们认识世界的基本手段.在研究和解决问题过程中,不仅需要相应的知识,还要注意运用科学方法.
- 随着水体富营养化程度日趋严重,淡水湖泊藻类水华频繁发生。人工打捞和投放大量化学杀藻剂紧急处理是常用的治理方法。近年来,研
- ......
- 用力拉动一物体使其以加速度在水平面上做匀加速直线运动。力的水平分量为,两者之间的夹角为,如图4示。若以与大小、方向都相同
- (16分)下表为元素周期表的一部分,请用化学用语回答下列问题: 族 周期 IA 0 1 ① ⅡA ⅢA ⅣA ⅤA
- 等腰梯形的腰与上底相等且等于下底的一半,则该梯形对角线与下底的夹角为________;
- 如图所示,甲容器容积固定不变,乙容器有可移动的活塞.甲中充入2mol SO2和1mol O2,乙中充入4mol SO3和
- 在甲、乙两烧杯的溶液中,含有大量的Cu2+、Na+、H+、SO42-、CO32-、OH-等6种离子,已知甲烧杯中的溶液显




