高中 化学
-
(1) A的结构简式是。
-
(2) A中的碳原子是否都处于同一平面?(填“是”或“不是”)。
-
(3) 在图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

I.C的化学名称是;
II.反应⑤的化学方程式为;
III.D2的结构简式是;④、⑥的反应类型依次是、。
 的实验,不能达到相应实验目的的是( )
的实验,不能达到相应实验目的的是( )
 B . 用图2所示方法闻
B . 用图2所示方法闻 的气味
C . 用图3装置检验
的气味
C . 用图3装置检验 与
与 溶液是否反应
D . 用图4装置观察
溶液是否反应
D . 用图4装置观察 与
与 反应的现象
反应的现象
下列装置所示的实验中,能达到实验目的的是( )
A. 分离碘和酒精  B. 除去Cl2中的HCl
B. 除去Cl2中的HCl 
C. 实验室制氨气 
![]() D. 排水法收集NO
D. 排水法收集NO 
下列实验操作中错误的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.蒸馏中,冷却水应从冷凝管的上口通入,下口流出
D.蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热
下列有关金属的叙述正确的是( )
A.金属受外力作用时常常发生变形而不易折断,是由于金属离子之间有较强的作用
B.通常情况下,金属里的自由电子会发生定向移动,而形成电流
C.金属是借助金属离子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而降低
苯胺是一种良好的黑色燃料,俗称苯胺黑,可以通过如下方式合成
![]()
(1)基态铁原子价电子排布式为 。
(2) Fe2+的未成对电子数 。
(3)组成硝基苯的C、N、O三种元素的电负性由大到小顺序是____
 (4) CH4、NH3、H2O的键角由小到大的顺序是____
(4) CH4、NH3、H2O的键角由小到大的顺序是____
(5)苯胺中的C、N两元素的杂化方式分别是____、____
(6)苯胺在水中的溶解度远大于硝基苯的在水中的溶解度的原因是____
(7)某种单质铁的晶胞结构如图所示,假设铁原子的半径为a nm,则该种
铁的密度为 g/cm3。(列出计算表达式)
 |
已知25℃,某一元酸Ka(HA)=1.75![]() ,向20mL0.5mol·L-1的HA溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如下图所示。下列关于混合溶液的相关说法中正确的是
,向20mL0.5mol·L-1的HA溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如下图所示。下列关于混合溶液的相关说法中正确的是
A.HA的电离平衡常数:B点<A点
B.由水电离出的c(OH-):B点>C点
C.从A点到B点,混合溶液中可能存在:
c(A-)=c(Na+)
D.从B点到C点,混合溶液中一直存在:
c(Na+)>c(A-)>c(OH-)>c(H+)
对于苯乙烯(![]() )的下列叙述①能使酸性KMnO4溶液褪色、②可发生加聚反应、③可溶于水、④可溶于苯中、⑤能与浓硝酸发生取代反应、⑥所有的原子可能共平面,其中正确的是( )
)的下列叙述①能使酸性KMnO4溶液褪色、②可发生加聚反应、③可溶于水、④可溶于苯中、⑤能与浓硝酸发生取代反应、⑥所有的原子可能共平面,其中正确的是( )
A.仅①②④⑤ B.仅①②⑤⑥ C.仅①②④⑤⑥ D.全部正确
已知涤纶的主要成分是聚对苯二甲酸乙二醇酯。芳香化合物A可进行如下转化: (1)B的化学名称为 。(2)由C合成涤纶的化学方程式为
(1)B的化学名称为 。(2)由C合成涤纶的化学方程式为 ![]() 。(3)E的苯环上一氯代物仅有两种,E的结构简式为 。(4)A的结构简式 。(5)写出符合下列条件的E的同分异构体的结构简式 。①核磁共振氢谱显示苯环上仅有两种氢 ②可发生银镜反应和水解反应
。(3)E的苯环上一氯代物仅有两种,E的结构简式为 。(4)A的结构简式 。(5)写出符合下列条件的E的同分异构体的结构简式 。①核磁共振氢谱显示苯环上仅有两种氢 ②可发生银镜反应和水解反应
某科研小组设计出利用工业废酸(稀硫酸)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:

请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是(任写一点即可)_____________________________________。
(2)物质A最好使用下列物质中的____________(填选项序号)。
A.KMnO4 B.H2O2 C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在_____范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化得到一种高效的多功能处理剂(K2FeO4),写出该反应的离子方程式:__________________________。
在c(Ca2+)=0.1mol·L-1的新制漂白粉的溶液中,下列各组离子能大量共存的是
A.Na+、K+、CO32-、NO3- B.Na+、K+、SO32-、OH-
C. K+、Na+、NO3-、CH3COO- D. H+、NH4+、NO3-、SO42-
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是 。(2)A有2个不同的含氧官能团,其名称是 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)A还有另一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是 。
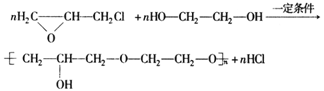 (5)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
(5)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是 。
下表是25 ℃时某些弱酸的电离平衡常数。
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。
如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )

A.甲池中负极上的电极反应式为N2H4-4e-===N2+4H+
B.乙池中石墨电极上发生的反应为4OH--4e-===2H2O+O2↑
C.甲池溶液pH增大,乙池溶液 pH减小
D.甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
- 如图,在△ABC中,AB=10,AC=8,则BC边上的中线AD的取值范围是( ) A.2<AD<18
- 2014年人们纷纷发问“时间都去哪儿了”。德国慕尼黑大学的研究发现,年龄在20~59岁的人普遍感到无法在既定时间内完成自
- “国家无非是一个阶级镇压另一个阶级的机器,这一点即便在民主共和制下也丝毫不比君主制下差。”这段话表明 A.国家是阶级矛盾
- 阅读《耳根的清静》,完成题目(13分)⑴我一直认为,在上苍给人类原配的生存元素和美学资源中,“寂静”乃最贵重的成分之一。
- 如图所示,甲、乙、丙三个轮子依靠摩擦传动,相互之间不打滑,其半径分别为r1、r2、r3.若甲轮的角速度为,则丙轮的角速度
- 下列解说不正确的一项是( ) A.戴望舒是中国现代诗人,主要诗集有《我的记忆》、《望舒草》、《望舒诗稿》、《灾难的
- 若x、y是正数,则(x+)2+(y+)2的最小值是__________.
- 美国总统奥巴马在组阁时不但提名党内预选时的“劲敌”希拉里为国务卿,还邀请共和党国防部长盖茨留任。昔日竞选时恶语相向“打”
- 歌曲《龙的传人》有一句歌词——“黑眼睛黑头发黄皮肤,永永远远是龙的传人。”作为龙的传人的中华民族把_________和_
- 书香使我充实,书香让我陶醉,书香伴我成长…… 请以“书香作伴”为题写一篇文章。要求:(1)除诗歌外文体不限。(2)字数不
- 如图,AB是⊙O的直径,弦CD⊥AB于点E,∠CDB=30°,⊙O的半径为cm,则弦CD的长为()A. cmB.3cmC
- 下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是( )A.11和16 B.12和9
- 国家杂交水稻工程技术研究中心暨湖南杂交水稻研究中心主任、中国工程院院士袁隆平获得“全国敬业奉献道德模范”称号,这个称号属
- 某气体的摩尔质量是M g·mol-1,分子数为N,在标准状况下所占的体积是VL,质量是mg。某元素原子的摩尔质量是Ag·
- 某人乘小船以一定的速率垂直河岸向对岸驶去,当水流匀速时,关于他渡河所需时间、发生的位移与水流速度的关系的说法中正确的是
- 近代英、法、美资产阶级革命后确立了代议制民主政治。代议制的核心是( ) A、实行民主共和政体
- ________moment he saw Zhao Benshan’s funny performances, he
- (2011年唐山一模)Say“Cheese” but keep________while I take yourpho
- 在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的是( )。
- 美国记者史沫特莱曾对一场战役作这样报道:“整个华北地区,从晋北山区到东海岸。从南面的黄河到北面的长城,都成了战场,……一



