高中 化学
 )常用于制造汽车安全气囊。实验室制备水合肼(
)常用于制造汽车安全气囊。实验室制备水合肼( )并利用其还原性进一步反应制取
)并利用其还原性进一步反应制取 的流程如下:
的流程如下:
已知:①一定条件下,碱性NaClO溶液与尿素溶液反应生成 ;
;
② 室温时在水中的溶解度为42g,其微溶于乙醇,向
室温时在水中的溶解度为42g,其微溶于乙醇,向 饱和溶液中加入乙醇会析出
饱和溶液中加入乙醇会析出 固体。
固体。
回答下列问题:
-
(1) 在一定温度下,吸收塔中可提高
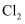 吸收率的措施为(答出一点即可)。
吸收率的措施为(答出一点即可)。
-
(2) 反应器1中生成水合肼反应的化学方程式为。为提高水合肼的产率,反应器1中NaClO和尿素的添加顺序为。
-
(3) 亚硝酸乙酯(
 )、NaOH和水合肼(
)、NaOH和水合肼( )反应生成
)反应生成 , 其原理如下:
, 其原理如下: , 若生成7.8g
, 若生成7.8g , 则该反应中转移电子的物质的量为mol。
, 则该反应中转移电子的物质的量为mol。
-
(4) 实验室也可以
 与
与 制备
制备 , 所得固体粗产品中含有少量的
, 所得固体粗产品中含有少量的 , 已知
, 已知 与水反应生成NaOH和
与水反应生成NaOH和 , 写出以21g粗产品获得
, 写出以21g粗产品获得 固体的实验步骤:,低温干燥。(须用试剂:乙醇、蒸馏水)
固体的实验步骤:,低温干燥。(须用试剂:乙醇、蒸馏水)
 B .
B .  C .
C .  D .
D . 

-
(1) 操作①、②、③、⑤中所需加入试剂分别为、、、.
-
(2) 操作①、④、⑥的操作名称分别为、、.
-
(3) 写出有关的化学方程式:
第②步:.
第⑤步:.
-
(4) 操作④所用到的玻璃仪器有.
下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
甲 | 乙 | 丙 | 戊 | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |

( )
-
(1) 请写出基态Ga原子的核外电子排布式。同周期主族元素中基态原子未成对电子数与Ga相同的有。(填元素符号)。
-
(2) EMIC阳离子中的几种元素电负性由大到小顺序为。
-
(3) 已知分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为。
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为。
-
(4) GaCl3熔点为77.8℃,GaF3熔点高于1000℃,其原因是。
-
(5) GaCl3和EMIC混合形成离子液体的过程中会存在以下转变:GaCl3
 GaCl4
GaCl4 Ga2Cl7 请写出Ga2Cl
Ga2Cl7 请写出Ga2Cl 的结构式。
的结构式。
-
(6) 某种Ga的氧化物晶胞结构如图所示。O2﹣以六方密堆积形成晶胞,Ga3+位于由A、C、D四个O2﹣围成的四边形的中心,但晶胞中只有的四边形中心位置占据了Ga3+ , 另外
 的位置空置。
的位置空置。①Ga3+位于O2﹣围成的面体空隙中。
②该晶胞中O2﹣的配位数为。
③若该晶胞的体积为Vcm3 , 该氧化物晶体密度为。

-如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验。试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色)。

(1)A的化学式为 ,E的名称为 。
(2)I和F反应的离子方程式是 。
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是
,阳极的电极反应式为 ,阴极的电极反应式为 ,电解的化学方程式为 。
有一包白色固体,可能是NaCl、K2CO3、K2SO4、CuSO4和BaCl2中的一种或几种。将此白色固体溶解于水时,有白色沉淀生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
通过上述实验现象分析:该白色固体中一定含有的物质为 ,不可能含有的物质为 ,不能确定的物质是 ,为了确定该物质是否存在,可以通过 实验确定。
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
在实验室要从煤焦油中提取少量苯酚需要用到的试剂合适的是
A.浓溴水、NaOH溶液 B.CO2气体、NaOH溶液
C.酒精 D.NaOH溶液、稀HCl
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572kJ·mol-1。请回答下列问题:
(1)生成物能量总和_____(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量______(填“大于”“小于”或“等于”)572kJ。
(3)H2的标准燃烧热ΔH=_____。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。

已知拆开1molH2、1molO2和1 mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)_____(填“吸收”或“放出”)_____kJ。
认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为________________。
(2)装置A中总反应的离子方程式为____________________________________。
(3)若装置E中的目的是在Cu材料上镀银,则X为___________,极板N的材料为____________。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为___________。
(4)当装置A中Cu电极质量改变6.4g时,装置中产生的气体体积共为___________。(标准状况下)
下列溶液中微粒的物质的量浓度关系正确的是( )
A. 0.1mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合后的溶液:
c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
B. 等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C. pH=2的HA溶液与pH=12的NaOH溶液等体积混合:c(Na+)=c(A-)>c(OH-)=c(H+)
D. 某二元弱酸的酸式盐NaHA溶液中:c(OH-)+c(H2A)=c(H+)+2c(A2-)
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
.根据下列实验操作和现象所得到的结论正确的是【 】
| 选项 | 实验操作和现象 | 结论 |
| A | 利用Ca(OH)2溶液鉴别Na2CO3和NaHCO3两溶液 | 有沉淀生成的是Na2CO3 |
| B | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
| D | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
- ------I have just had my watch repaired. ------How much did
- 在一个新鲜萝卜中挖一凹槽,在凹槽中放入浓盐水.一段时间后,萝卜变软,凹槽中水分增多.下列图示的实验与此实验原理差异最大的
- 下列这组图片与1992年后城市国有企业改革的哪项内容相关?( )A.改革管理体制,把所有权与经营权分开 B.改革所有
- 对于任意的直线l与平面a,在平面a内必有直线m,使m与l
- 阅读下文,完成14—17题。(16分) 苦 瓜 肖复兴 原来我家有个小院,院里可以种些花草和蔬菜。
- 12.补写出下列句子中的空缺部分。 (1)《诗经·氓》中用比兴手法写弃妇面容憔悴与被弃的痛苦的句子是:
- 一个长螺线管中通有电流,把一个带电粒子沿中轴线射入(若不计重力影响),粒子将在管中 A、做圆周运动B、沿轴线来回运
- 根据句意,从方框中选择恰当的单词或短语填空。allow, too many, wrong,guess, work ou
- 如图,有一半径为R的半圆形曲面MPQ,质量为2m的A球与质量为m的B球, 用轻质绳连接后挂在圆柱曲面边缘.现将A球从边缘
- It is high time for us to take measures to protect these old
- 下列各句中,没有语病的一句是 () A.为了总结开展“研究性学
- 圣琵琶传闻 有书生欲游吴地,道经江西,因风阻泊船,闲步入林,过①一僧院。僧已他出,房门外,小廊数间,傍有笔砚。书生攻②画
- I wonder _________Eddie has gone to Singapore.A.how longB.ho
- 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为: 4Na+3CO22Na2CO3+C,其工作原理
- 下列关于蛋白质和氨基酸的叙述,正确的是() A.具有生物催化作用的酶都是由氨基酸组成的 B.高等动物能合成生命活动所需的
- 14.阅读下面这首词,完成题目。 南柯子·忆旧 仲 殊 十里青山远,潮平路带沙。数声啼鸟怨年华,又是凄凉时候在天涯。
- 依次填入下面一段文字横线处的语句,与上下文衔接最恰当的一组是 发射窗口定在凌晨。___________。火箭______
- (2009.海南月考)下列有关村民自治的观点中,正确的是
- 新发明改变了我们的生活,同时出现了很多新的职业,下列职业按出现先后排序正确的是 A、电话接线员—火车司机—空姐—
- “中国制造”在国际市场上素以“物美价廉”著称。但现在,低价鞋给贸易保护主义者以口实,国外反倾销已成为我国鞋类出口的极大障



