高中 化学

-
(1) 玻璃管E内发生反应的化学方程式为.
-
(2) 小试管C的作用是.
-
(3) 广口瓶D内盛的试剂是,
-
(4) 若U形管内收集到的物质很少,分析其原因,不可能的是.(填序号)
①装置气密性不好
②制得的SO2中混有少量H2S杂质,使催化剂中毒
③气流速度过快
-
(5) 从U形管导出的尾气的处理方法是.
①试管②烧杯③量筒④蒸发皿⑤锥形瓶⑥温度计⑦蒸馏烧瓶⑧分流漏斗
回答下列问题:
-
(1) 可以直接加热的有(填序号,下同);
-
(2) 加热时必须垫上石棉网的有;
-
(3) 使用前必须查漏的有;
-
(4) 可作反应容器的有.

| 选项 | | | | |
| A | 浓硝酸 | | | |
| B | 浓氨水 | | | |
| C | 浓盐酸 | | | |
| D | 浓硫酸 | | | |
-
(1) I.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂等。
向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2+(不考虑空间构型),[Cu(OH)4]2+结构可用示意图表示为。
-
(2) 胆矾CuSO4•5H2O可写为[Cu(H2O)4]SO4•H2O,其结构示意如图:则关于 [Cu(H2O)4]SO4的下列说法中错误的是________
 A . 此配合物中心离子的配位数为4 B . 配体为H2O,配位原子是氧原子 C . 此配合物中Cu2+提供孤对电子 D . 向此配合物溶液中加入BaCl2溶液,将出现白色沉淀
A . 此配合物中心离子的配位数为4 B . 配体为H2O,配位原子是氧原子 C . 此配合物中Cu2+提供孤对电子 D . 向此配合物溶液中加入BaCl2溶液,将出现白色沉淀 -
(3) II.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。
若所得的Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合,所得离子显红色,该离子的离子符号是。
-
(4) 若所得的Fe3+和SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示。
 、
、 来制备Mg、Al
D . 大部分食品因在空气中被氧化而变质,所以需要加入防腐剂
来制备Mg、Al
D . 大部分食品因在空气中被氧化而变质,所以需要加入防腐剂

下列关于维生素C的说法错误的是( )

 )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
-
(1) Fe2+基态核外电子排布式为。
-
(2) N、P、O三种元素的电负性由大到小的顺序为。
-
(3) CO32-中心原子轨道的杂化类型为;与CO32-互为等电子体的一种分子为(填化学式)。
-
(4) 1 mol苯胺分子中含有σ键的数目为;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是。
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO![]() ,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )
,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是(双选)( )

A.氧化性强弱:I2<Fe3+<IO![]()
B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I-+6Cl2===5I2+2Fe3++12Cl-
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I-+3Cl2===2I2+2Fe3++6Cl-
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。
(2)若测定结果偏高,其原因可能是_____________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后又用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(3)判断滴定终点的现象是______________________。
(4)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
为测定某碳酸钠样品的含量,取一定量碳酸钠样品投入到100mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),标准状况下生成448mL CO2。请计算:
(1)该碳酸钠样品中碳酸钠的质量;
(2)盐酸的物质的量浓度。
.(6分)(其他方法结果正确,过程无错误也给满分,若有错误则按步得分)
.[化学-有机化学基础](13分)
对二甲苯(英文名称p-xylene),缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PA的一种同分异构体。

①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是 。
②D分子所含官能团是 (填名称)。
③C分子有一个碳原子连接乙基和正丁基,DEHP的结构简式是 。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式 。
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是________。
(2)证明有Fe(OH)3胶体生成的实验操作是___________________________________________________,利用的胶体性质是_______________________________________________。
(3)在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:①将其装入U形管内,用石墨作电极,通电一段时间后发现阴极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带________(填“正”或“负”)电荷。②向其中加入饱和Na2SO4溶液,产生的现象是________。
实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按下图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。

(1)写出制取乙酸乙酯的化学方程式:___________________________________。
(2)在反应未开始前,乙试管中所盛溶液为____________________。
、![]() 转变为
转变为![]() 的方法是
的方法是
A.与足量NaOH溶液共热后,再通CO2
B.溶液加热,通入足量的SO2
C.与稀硫酸共热后,加入足量NaOH溶液
D.与足量稀硫酸共热后,加入足量Na2CO3
A. N—Cl键是极性键 B. NCl3分子为极性分子
C. 氨气是电解质 D. Al(OH)3难溶于氨水
- 石头纸是一种新型、环保纸张。它与传统的木浆纸不同,是将碳酸钙粉末加上15%的聚乙烯和5%的胶合剂,经特殊工艺处理后制成。
- 已知复数的模小于,则实数的取值范围是 。
- 如图,AB、AC切⊙O于B、C,AO交⊙O于D,过D作⊙O切线分别交AB、AC于E、F,若OB=6,AO=10,则△AE
- 下面短文中有10处语法错误。请在有错误的地方增加、删除或修改某个单词。 增加:在缺词处加一个漏字符号(∧),并在其下面写
- 用下列药品,完成对应的“家庭小实验”,不能达到预期目的的是A.用柠檬酸、果汁、白糖、水、小苏打等制汽水B.用空塑料瓶、小
- 下列突发事件处理方法正确的是: A.电器着火,立即用水烧灭 B.煤气泄漏,立即开灯查看 C.房间着火,立即开
- 某,样品中含有、和三种杂质中的一种或两种。现将13.8g样品加入到足量水中,样品全部溶解。再加入过量的溶液,得到9g沉淀
- 阅读下文,完成文后各题。 有关收入分化的研究已经很多,也达成了不少研究共识,但是对于利益分化的研究相对来说还比较薄弱。收
- 下列各句中加点的熟语使用恰当的一句是( ) A.刘师傅生性耿直,好打抱不平,对看不惯的人和事总是鸡蛋里挑骨头,
- 在同一面内共点的四个力F1、F2、F3、F4的大小依次是19 N、40 N、30 N和15 N。方向如图3-5-13所示
- Be careful ! The slightest spark could ______ the fireworks
- 西方报纸称:“甲午以后,中国有三党:守旧党……意在保存现在之局面;中立党……意在保国以变法;维新党……意以作乱为自振之机
- 下列命题:①若一个四边形的四条边不相等,则它不是正方形;②若一个四边形对角互补,则它内接于圆;③正方形的四条边相等;④圆
- 下列说法中,正确的是 A.强电解质溶液一定比弱电解质溶液导电能力强 B.强电解质的水溶液中不存在溶质分子 C.强电解质都
- 下图表示20℃时玉米光合作用强度与光照强度的关系,S1、S2、S3表示所在部位的面积,下列说法中不正确的是() A.S
- 基尼系数,是国际上用来综合考察居民内部收入分配差异状况的一个重要分析指标。它是一个比值,数值在0和1之间。基尼系数的数值
- 长方体的共顶点的三个侧面面积分别为3,5,15,则它的体积为_____________.
- 消费者物价指数(简称CPI)是反映与居民生活有关的商品及劳务价格统计出来的物价变动指标,通常作为观察通货膨胀水平的重要指
- (07年辽宁卷)下列语句没有语病的一项是 A.玛丽安在路边的碎石堆里偶然发现了几个形状奇特的化石牙齿,兴奋异常,却
- 为训练宇航员适应失重状态,需要创造失重的环境,在地球表面附近,可以在飞行器的座舱内短时间地进失重实验。设想某一飞行器可作
 中的物质
中的物质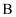 中的物质
中的物质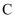 中收集的气体
中收集的气体 中的物质
中的物质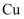

 溶液
溶液








