初中 化学
如图是甲、乙两种固体物质的溶解度曲线,请根据图示判断,下列选项中不正确的是( )


-
(1) 可用于急救病人的气体是
-
(2) 造成温室效性的气体是;
-
(3) 燃烧时发出耀眼的白光,可用做照明弹的是,反应的化学方程式为;
-
(4) 白磷的着火点很低,容易自燃,反应的化学方程式为;
-
(5) 细铁丝在氧气中燃烧,预先要在瓶底留些水或铺一薄层细沙,反应的化学方程式为.
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
-
(1) 实验结论:过氧化钙与水反应(填“能”或“不能”)用于实验室制取氧气。
-
(2) 【分析与反思】
小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议。
-
(3) 同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。你认为猜想(填序号)一定是错误的,理由是


-
(1) 写出图中标号①仪器名称:①;
-
(2) 实验室欲用高锰酸钾制取氧气,应选择的气体发生装置是,产生氧气的化学方程式为;
-
(3) 已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气。现需制取干燥的氧气,导管端口连接顺序为a→→→i
-
(4) 通过上述两种制取氧气的方法所选用发生装置的对比,你觉得选择气体发生装置应考虑反应物状态外还要考虑;
 高温煅烧一定质量的石灰石,剩余固体质量随时间的变化
B .
高温煅烧一定质量的石灰石,剩余固体质量随时间的变化
B .  某物质的着火点为t℃,则图中P点时,该物质燃烧得最旺
C .
某物质的着火点为t℃,则图中P点时,该物质燃烧得最旺
C .  20℃时,向一定量接近饱和的KNO3溶液中加入KNO3固体
D .
20℃时,向一定量接近饱和的KNO3溶液中加入KNO3固体
D .  向一定量
向一定量  溶液中逐滴加入稀盐酸至过量,溶液pH的变化
溶液中逐滴加入稀盐酸至过量,溶液pH的变化


 Fe3O4
B . 气球先膨胀后又变小
C . 激光手电照射使纳米铁粉的着火点降低
D . 锥形瓶中的水可防止生成物溅落炸裂瓶底
Fe3O4
B . 气球先膨胀后又变小
C . 激光手电照射使纳米铁粉的着火点降低
D . 锥形瓶中的水可防止生成物溅落炸裂瓶底
 :表示镁离子带有两个单位正电荷
C .
:表示镁离子带有两个单位正电荷
C .  :表示一个氧分子由两个氧原子构成
D .
:表示一个氧分子由两个氧原子构成
D .  :表示氧元素的化合价为
:表示氧元素的化合价为 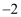 价
价
 2Fe2O3
B . 2Fe+6HCl=2FeCl3+3H2↑
C . 3CuSO4+2Fe=Fe2(SO4)3+3Cu
D . Fe+H2SO4=FeSO4+H2↑
2Fe2O3
B . 2Fe+6HCl=2FeCl3+3H2↑
C . 3CuSO4+2Fe=Fe2(SO4)3+3Cu
D . Fe+H2SO4=FeSO4+H2↑

 降温到
降温到  ,一定有晶体析出
C .
,一定有晶体析出
C .  时,50g的a溶于50g水,溶液的质量分数为
时,50g的a溶于50g水,溶液的质量分数为  D . c的饱和溶液由
D . c的饱和溶液由  降温到
降温到  ,溶液的质量分数不变
,溶液的质量分数不变
 )具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
)具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
-
(1) 花青素由种元素组成;
-
(2) 一个花青素分子中共有个原子;
-
(3) 花青素分子中碳、氧元素的质量比为;
-
(4) 花青素的相对分子质量为;
-
(5) 花青素中氧元素的质量分数为。(计算结果精确到0.1%)
A | 在待测液中加石蕊试液,溶液变成红色 | 所测溶液一定是酸溶液 |
B | 在待测液中加氢氧化钠溶液,产生蓝色絮状沉淀 | 所测溶液中一定含Cu2+ |
C | 在待测液中加氯化钡溶液,生成不溶于稀硝酸的白色沉淀 | 所测溶液中一定含SO42﹣ |
D | 在待测液中加稀盐酸,产生无色无味的气体 | 所测溶液中一定含CO32﹣ |
下列说法正确的是( )
A.分子是化学变化中的最小粒子 B.不同元素的本质区别是电子数不同
C.原子核由电子和质子构成 D.墙内开花墙外香说明分子在不断运动
 我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠)。
我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠)。
(1)右图是碳酸钠和氯化钠在不同温度下的溶解曲线,其中表示碳酸钠
溶解度的曲线是(填序号)_________________
(2)从湖水中得到碳酸钠常含有少量的氯化钠,可以用_______的方法得
到纯净的碳酸钠。
制造汽车要用到含铜、铁、铝等成分的多种金属材料。
(1)在汽车电路中,经常用铜作导线,这是利用了铜的 性。
(2)车体多用钢材制造。其表面喷漆可有效防止与 接触而生锈。
(3)工业上用CO还原赤铁矿冶炼金属铁的化学方程式为
![]() 。
。
(4)在实验室中探究铜和银的金属活动性顺序,除铜、银外,还需要用到的试剂是 。(填一种即可)
- 有人认为:“从实力上讲,孙中山比起洪秀全来,相差不知几千万里了,而诺大的清帝国,不亡于洪、杨,却被孙文的几个口号叫垮了,
- 下列说法正确的是 A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 B.酸和碱发生中和反应生
- 台湾自古以来就是中国的领土。民族英雄郑成功在给殖民者的信中说:“台湾者,中国之地也,久为贵国所踞……”信中所说的“贵国”
- 下列说法不正确的是( )A.+→+是聚变B.+→++2是裂变C.→+是裂变D.→+是α衰变
- 阅读下面的文言文,完成后面的题目。 薛嵩,绛州万泉人。祖仁贵,高宗朝名将,封平阳郡公。父楚玉,为范阳、平卢节度使。嵩少以
- New computers are soon out of date since newer modelsare ___
- 已知等腰△ABC中,AB=AC=13,BC=10,求顶角∠A的四种三角函数值.
- ______ the police thought he was the most likely one, since
- 结合图示实验装置,回答下列问题。 (1) 图中a、b仪器的名称:a ,b
- 单项选择: My name’s ____.I am an English boy. A. Green Gina
- 亚洲是世界第一大洲,表现在诸多方面,下列说法中错误的是( ) A.跨纬度最广 B.东西距
- 下列叙述不正确的是 A.细胞凋亡是一个被动的过程,细胞坏死则是一个主动的过程 B.细胞凋亡是由遗传机制决定的细胞死亡 C
- (07年石景山一模文) 把函数的图象向右平移个单位,所得图象对应函数的最小正周期是( ) A.
- 如图,由四个边长为1的小正方形构成一个大正方形,连接小正方形的三个顶点,可得到△ABC,则△ABC中BC边上的高是.
- 现有甲、乙、丙、丁甲种颗粒大小相同的金属,分别投入相同的稀硫酸中,只有甲、乙表面有气泡产生,且甲产生气泡较快;再把丙和丁
- 下列各组离子在常温下一定能大量共存的是() A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ B.在c(H
- 维生素C是人体必需的物质,缺乏它将会患坏血病,它主要有在于( ) A.动物肝脏
- A Book Review—TheSnakeStone by Berlie Doherty The setting:
- 维生素C(C6H8O6)是重要的营养物质,能促进人体的生长发育,增强人的体质.它主要存在于水果、蔬菜中.下列关于维生素C
- 阅读下面的文字,完成37—42题。 杨掞字纯父,抚州临川人。少能词赋,里陈氏馆之教子,数月拂衣去。用故人荐,出淮阃杜杲幕




