初中 化学
-
(1) 乳酸的相对分子质量;
-
(2) 乳酸中各元素的质量比;
-
(3) 180g乳酸所含氢元素的质量是多少?

-
(1) B的化学式为,F的化学式为.
-
(2) 黑色固体甲与X反应的化学方程式为.
-
(3) 蓝色溶液与E反应的化学方程式为,它的化学反应基本类型为.

-
(1) 金属铝耐腐蚀性较强的原因是;
-
(2) 已知
 ,则
,则 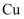 、
、  、
、  三种金属的金属活动性由强到弱的顺序为:;
三种金属的金属活动性由强到弱的顺序为:;
-
(3) 向
 和
和 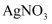 的混合溶液中加入一定量的
的混合溶液中加入一定量的  粉,充分反应后过滤,得到无色滤液和金属滤渣,此时所得金属滤渣的成分为。
粉,充分反应后过滤,得到无色滤液和金属滤渣,此时所得金属滤渣的成分为。
 B . 取用固体
B . 取用固体  C . 取用液体
C . 取用液体  D . 加热液体
D . 加热液体 
(1)双氧水分解的化学方程式是 .
(2)欲分离反应后得到的二氧化锰,用到的仪器除烧杯、玻璃棒外,还有 .
(3)实验室用此法代替氯酸钾和二氧化锰共热制取氧气,请你简述其优点:①;② .

【查阅资料】FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
-
(1) 用盐酸除铁锈的化学方程式为 。
-
(2) 实验1-1的目的是 。
-
(3) 综合分析实验1,溶液从黄色变浅绿色的可能原因是 。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号
所用试剂
实验现象
反应开始时
24h后
2-1
铁锈和2%盐酸
铁锈、溶液均无明显变化
铁锈消失,溶液变黄色
2-2
生锈铁钉和2%盐酸
生锈铁钉、溶液均无明显变化
铁锈消失,溶液变浅绿色
2-3
生锈铁钉和6%盐酸
铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色
溶液变为浅绿色
2-4
生锈铁钉和10%盐酸
铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色
溶液变为浅绿色
-
(4) 生锈铁钉与盐酸反应时,溶液的颜色变化与 有关。
-
(5) 2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为 。
-
(6) 基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是 (填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
-
(1) 采用操作可除去污水中的碎菜叶、碎塑料薄膜、泥沙等。
-
(2) 用(填物质名称),可以除去污水中的臭味。
-
(3) 把生活污水回收处理,进行再利用的目的是。
-
(1) 人体中化学元素含量的多少直接影响人体的健康,缺少(填元素符号)元素有可能导致骨质疏松、畸形,易得佝偻病。
-
(2) 用洗洁精洗去餐具上的油污,这是利用了洗洁精的作用。
-
(3) 葡萄糖(化学式为C6H12O6)是一种重要的营养物质。葡萄糖由种元素组成,一个葡萄糖分子中有个原子,其中氢、氧元素质量比为。
-
(4) 目前,人类使用的燃科大多来自化石燃料。燃烧含硫化石燃料会产生二氧化硫,请写出硫在空气中燃烧的化学方程式:。大量二氧化硫释放到空气中会导致雨水的pH(填“大于”或“小于”)5.6,形成酸雨。

-
(1) 镁元素的相对原子质量为。
-
(2) B图中X = ,B微粒的符号是。
-
(3) 下图是镁在点燃条件下与某物质发生化学反应的微观示意图。

该反应的化学方程式为:。
①取样,加足量的水,充分搅拌后过滤,得到白色沉淀 A 和无色溶液 B.
②在白色沉淀 A 中加入足量的稀硝酸,沉淀部分溶解,并放出能使石灰水变浑浊的无色气体.
③在无色溶液 B 中加入足量的 Ba(OH)2溶液,又得到白色沉淀;再加入足量的稀硝酸,仅观察到沉淀部 分溶解的现象.
请回答:
-
(1) 原白色固体由组成.
-
(2) 实验③中沉淀溶解的化学方程式为:.
-
(1) 利用有关碳的知识完成下列填空。
①石墨因具有性可作干电池的正极。
②利用活性炭的性可进行食品添加剂的脱色;
③日常生活中人们常把煤做成蜂窝状的目的是。
-
(2) 香蕉、苹果、黄瓜等水果中,富含的主要营养素是。
-
(3) 下列疾病中,与缺少钙元素有关的是(填字母序号)。
A 骨质疏松 B 坏血病 C 佝偻病 D 贫血 F 大脖子病
-
(4) 洪涝地区的灾民将河水转化为可饮用水,以下处理顺序合理的是。
①化学沉降(用明矾)②消毒杀菌③自然沉降④加热煮沸
A ③②①④ B ③①②④ C ③①④② D ①③④②

给试管里的液体加热,液体体积一般不超过试管容积的____________;加热试管时要使用试管夹的____________,手握试管夹的,不要把拇指按在____________,而且应该从试管的____________往上套,固定在离试管口的____________处;加热时,试管倾斜跟桌面成____________,先使试管均匀受热,然后给试管里的液体的部位加热,并且不时地上下____________试管;为了避免伤人,加热时切记不可使试管口对着____________。
下列说法正确的是( )
A.电解水产生氢气和氧气,说明水是由氢分子和氧分子构成的
B.电解水中,正负极的气体质量比为1:2
C.电解水,说明原子是化学变化中最小微粒
D.电解水中,正负极产生的气体体积比为2:1
纯净物由_____________物质组成,混合_____________物由物质组成。
随着人们生活水平的提高,汽车已经走进了千家万户,成为许多家庭的代步工具.也许你的家庭就拥有一台不错得轿车,那就请根据你对汽车的了解及所学的化学知识回答下列问题:
(1)新能源电动汽车采用的电池为高铁蓄电池,其在行驶过程中能量转化是
(2)车体多用钢材制造,钢材生锈是铁与空气中的氧气、水蒸气等反应的结果,可以采取 的方法来防止钢材生锈.
(3)叠氮化钠{NaN3}被广泛应用于汽车气囊.制备工业级NaN3如下:将NaNH2与N2O气体反应可生成NaN3、NaOH和溶于水呈碱性的刺激性气味气体,该反应的化学方程式是 ,反应前氮元素的化合价分别为 .


- Dolly’s death, like her birth, ________________(注定)raise wor
- 老子说:“民之饥,以其上食税之多,是以饥民之难治,以其上之有为,是以难治。“这实际上主张( )A.民贵君轻,实行仁
- .下列说法中,正确的是( )A. 图形的平移是指把图形沿水平方向移动。 B. 平移前后图形的形状和大小都没有发生改变
- ......
- .一种特殊飞机,加速滑行时,加速度a=4.0 m/s2.设当飞机速率达到85 m/s时就可升空.如果允许飞机在达到起飞速
- 右图为“世界某区域海洋与陆地自然带分布图”。读图完成25~27题25.沿X→Y→Z自然景观的变化规律依次是 A.阔叶林→
- 下列事件发生在第一个五年计划期间的是( )①土地改革的完成 ②社会主义制度的确立 ③制定第一
- 孔子崇尚“述而不作”的原则,他的弟子曾参将其主要言论集结编篡成《论语》,从而将孔子的思想形诸文字。如果不是他的弟子的努力
- 在铂催化剂和加热的条件下,氨气与氧气反应的化学方程式为_______________________,氧化剂是_____
- 磁悬浮列车是利用同名磁极相互______的原理实现悬浮,从而大大减少摩擦力,来提高列车的速度.
- 完形填空(共20小题;每小题1.5分,满分30分) 阅读下面短文,从短文后各题所给的四个选项(A、B、C和D)中,选出可
- 下列物质变化示意图中,哪个不可能发生在有丝分裂过程中()
- 已知、均为单位向量,它们的夹角为60°,那么( ) A. B.
- 有一化学方程式aC2H2+bO2mCO2+nH2O,据此判断下列关系式正确的是() A.2a=m B.a=2m C.b=
- 1.白云航空公司有若干个飞机场,每两个飞机场之间都开辟一条航线,一共开辟了10条航线,则这个航空公司共有飞机场( )
- 下列词语中加线的字,注音全都正确的一组是 ( ) A.蚕(chán)丛 鱼凫(fú)
- 我校某班同学想探究红砖粉末是否也可作为过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白:(1)[提出问题
- 从以下两题中任选一题作文。 要求:①若选⑴题,请补全题目再作文。②除诗歌外,文体不限,不少于600字。③作文中不得出现与
- 如图所示的几何体的俯视图是( )
- 如图所示,在平面直角坐标系xoy中,一组同心圆的圆心为坐标原点O,它们的半径分别为1,2,3,…,按照“加1”依次递增;






