初中 化学

-
(1) 该活动小组将实验装置组装好后,设计了下列实验操作步骤:①给玻璃管加热;②停止加热;③通入一氧化碳气体;④停止通入一氧化碳气体。正确的操作步骤是(填序号);
-
(2) 玻璃管中出现的现象是,玻璃管中反应的化学方程式是,试管中出现的现象是。
-
(3) 图中有一处明显不正确,请说明改进方法。
第一步:验证废水酸性.往废水中滴加石蕊试液,石蕊变,说明废水呈酸性.
第二步:处理废水.该小组同学设计了以下两个方案.
方案一:用熟石灰处理废水,其反应的化学方程式为.
方案二:用BaCl2处理废水,观察到废水中出现.
经过分析,同学们认为方案二没有达到处理废水的目的,因为处理后的废水中含有较多的.
 二氧化硫
B . 酒精+氧气
二氧化硫
B . 酒精+氧气  水+二氧化碳
C . 碱式碳酸铜
水+二氧化碳
C . 碱式碳酸铜  氧化铜+水+二氧化碳
D . 碳酸氢铵
氧化铜+水+二氧化碳
D . 碳酸氢铵  氨气+水+二氧化碳
氨气+水+二氧化碳
硫酸溶液 | 实验条件 | 实验现象 |
10% | 不加热 | 30s铁锈脱落,50s出现较明显小气泡,90s溶液发红 |
10% | 酒精灯上加热 | 10s出现明显气泡,20s铁锈脱落,65s铁锈消失,溶液变黄 |
20% | 酒精灯上加热 | 5s出现明显气泡,10s铁锈脱落,45s铁锈消失,溶液变黄 |
-
(1) 溶液变黄是因为生成了。
-
(2) 用化学方程式表示溶液中出现气泡的原因:。
-
(3) 该实验可以得出的结论是。
| A | 保护环境的措施 | B | 物质与分类 |
| 减少化石燃料使用——减少雾霾 生活污水限排——减少水污染 垃圾分类回收——减少固体废弃物 | N2、C60——单质 空气、生铁——混合物 甲烷、乙醇——有机物 | ||
| C | 日常物质的区别 | D | 化学中常见的“三” |
| 硬水和软水——加肥皂水并搅拌 酱油和醋——闻气味 铜芯导线和铝芯导线——观察颜色 | 三种可燃性气体——H2、CO、O2 三种可加热仪器——试管、烧杯、蒸发皿 三种构成物质的粒子——分子、原子、离子 |
为测定某石灰石样品中碳酸钙的质量分数,取22.2克石灰石样品,放入盛有146克稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸均恰好完全反应(杂质不反应)放出气体,烧杯内物质质量变为159.4克
求(1)石灰石中碳酸钙的质量分数。
(2)盐酸中溶质的质量分数。
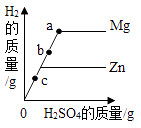
装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。有关量的变化情况见图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。其中肯定不正确的是( )
A. B.
B.
C. D.
D.
下列实验操作正确的是()
A.吸取药液 B.过滤
B.过滤
C.加热液体 D.倾倒液体
D.倾倒液体
水是人类生活中不可缺少的物质,日常生活中有人喜欢喝纯净水,市售纯净水中有些是蒸馏水,有关这类纯净水的下列说法中正确的是 ( )
A它是纯天然饮品,不含任何化学物质 B它含有人体所需的矿物质和多种微量元素
C它清洁、纯净,但长期饮用对健康无益 D用催化剂可将它转变为油
下列关于铁的说法中正确的是( )
A. 铁是地壳中含量最多的金属元素
B. 铁在氧气中燃烧生成氧化铁
C. 纯净的生铁属于金属单质
D. 铁在潮湿的空气中比在干燥的空气中易生锈
 小旭同学把烘干木炭粉末和氧化铜粉末混合均匀(
小旭同学把烘干木炭粉末和氧化铜粉末混合均匀(![]() 如右图),
如右图),
小心地铺放进试管,并将试管固定在铁架台上。
将导管通入澄清的石灰水中,并用酒精灯加网罩的目的是 ,
一会儿观察到(整套装置)的现象是 。实验结束后,
要先 然后 ,若将上述操作顺序颠倒,
澄清石灰水可能会倒流回试管内,利用物理化学知识解释此现象
的原因 。
用化学知识解释或说明下列生活中的问题
(1)餐具洗洁精可以洗去餐具上的油污,是因为洗洁精具有 作用。
(2)食盐的水溶液能够导电,是因为 。
(3)冬天常在汽车水箱中加入少量乙二醇能防止水箱中的水结冰。这是因为 。
(4)送入居民家中的天然气中常加入一种有臭味的物质(硫化氢),其作用是 。
(5)硫磺在空气中燃烧不如在氧气中燃烧剧烈 。
维生素C(化学为C6H8O6)主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素C的说法错误的是 ( )
A.维生素C的相对分子质量是176
B.维生素C中碳元素的质量分数为40.9%
C.维生素C是由碳元素、氧元素和氢元素组成
D.维生素C中C、H、O三种元素的质量比为6∶8 ∶6
- (36分) “民以食为天”,饮食是人类生存和发展的第一需要,它的变化可以折射出社会的变迁。 材料一 唐代麦的
- 甲、乙两个人通过同一平面镜看对方,下面说法正确的是( )A.根据光路可逆原理,在甲看到了乙的同时,乙也一定看到了甲B
- 已知下列反应: 反应Ⅰ:Co2O3 + 6HCl(浓)2CoCl2 + Cl2↑+3H2O反应Ⅱ:5Cl2+ I2 +
- 惯性知识的是 ( ) A.景区水池边立有“水深危险” B.商场走廊过道标有“小心碰头”
- They _______ to see me yesterdayevening. A.will com
- 完成句子。根据所给提示,完成句子。没空一词,含缩略词。 1.CaoHua swims fastest in our gr
- 已知a+b+c=0,求证:ab+bc+ca≤0.
- 如图所示,斜面倾角为45°,从斜面上方A点处由静止释放一个质量为m的弹性小球,在B点处和斜面碰撞,碰撞后速度大小不变,方
- 若等腰三角形的两条边的长分别为5cm和8cm,则它的周长是() A.13cm B.18cm C.21cm D.18cm或
- 下列关于哺乳动物胚胎发育和胚胎工程的叙述,正确的是( ) A.卵裂期胚胎中细胞数目和有机物总量在不断增加 B.胚胎
- 4.有人认为我国古代某一朝代的皇帝“身兼国家元首和政府首脑”,与这一结论相关的是 A.秦朝的三公九卿制
- 细胞中的染色体对生物体的意义是( ) A.能够将光能转化成化学能 B.能够合成有机物 C.能够控制物质的进出 D.
- 近期中央电视台播出的《舌尖上的中国》很受观众欢迎,该节目主要介绍中国的美食及其制作方法。“饮食健康”是人们普遍的生活追求
- 31.下图是DNA测序仪显示的某真核生物DNA片段一条链的碱基排列顺序图片。其中图1碱基排列顺序已经解读,其顺序是:GG
- .含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n:m可能 ①5:1、②9:2、③3:1、④
- 如图,小山的顶部是一块平地,在这块平地上有一高压输电的铁架,小山的斜坡的坡度,斜坡长是50米,在山坡的坡底处测得铁架顶端
- 两个氨基酸缩合成二肽并生成水,这个水分子中的氢原子来自氨基酸的( ) A.氨基 B.羧基
- 化学实验中,常将溶液或试剂酸化,下列酸化处理的措施中正确的是A.定性检验SO32-,将BaCl2溶液用HNO3酸化B.为
- 若sin(-α)=- ,sin(+β)=,其中<α<,<β<,求 角(α+β)的值。
- Fall is a time whencareer regrets become stronger than durin



