化学反应速率 知识点题库

 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空: 实验 序号 | 温度/℃ | 时间/min | ||||||
0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
-
(1) 在实验l过程中,10 min~20 min时间内用B表示该反应的平均化学反应速率为mol/(L·min)。
-
(2) 在实验2过程中,A的初始浓度c2=mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是。
-
(3) 设实验3的化学反应速率为v3 , 实验1的化学反应速率为v1 , 则v3v1 , 且c31.0 mol/L (填“<”、“>”或“=”)。
-
(4) 比较实验4和实验1,可推测该反应是反应(填“吸热”或“放热”)。理由是。
 2NO2(g) △H=+57 kJ·mol-1 , 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1 , 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( ) 

-
(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 KJ·mol-1、283. 0 KJ·mol-1、285. 8 KJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)的△H=
-
(2) 工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)
 CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示: 

①用H2表示的前2h的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
-
(3) 在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
(4) CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)
 C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按
C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按 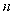 (CO2):
(CO2): 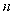 (H2)=1:3投料,如图所示为不同温度(
(H2)=1:3投料,如图所示为不同温度( 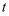 )下,平衡时四种气态物质的物质的量(
)下,平衡时四种气态物质的物质的量( 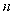 )的关系。
)的关系。 ①该反应的△H0(填“>”或“<”)。
②曲线
 表示的物质为(填化学式)。
表示的物质为(填化学式)。
 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.16 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.16 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
 )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为  )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
-
(1) 已知:①


②


③


则
 的
的  (用含
(用含  、
、  、
、  的代数式表示)。
的代数式表示)。 -
(2) 若在恒温恒容条件下,仅发生反应
 。
。
①下列说法正确的是(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
 的浓度为1.4 mol·L−1 , 充入一定量的
的浓度为1.4 mol·L−1 , 充入一定量的  ,反应再次达到平衡,
,反应再次达到平衡,  浓度(填“
浓度(填“  ”“
”“  ”或“
”或“  ”) 1.4 mol·L−1。
”) 1.4 mol·L−1。 -
(3) 在
 恒容密闭容器中充入
恒容密闭容器中充入  和
和  ,若仅发生反应:
,若仅发生反应: 
 ,
,  后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则  内,
内,  的反应速率为
的反应速率为  。
。
-
(4) 在恒容密闭容器中,加入足量的
 和
和  ,仅发生反应:
,仅发生反应: 

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:

①
 (填“
(填“  ”“
”“  ”或“
”或“  ”)0;比较
”)0;比较  、
、  、
、  的大小:。
的大小:。②若初始时通入
 ,
,  为
为  ,则
,则  点平衡常数
点平衡常数  (用气体平衡分压代替气体平衡浓度计算,分压
(用气体平衡分压代替气体平衡浓度计算,分压  总压
总压  气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
 xC+2D的体系中,若一开始在体系中冲入3molA和3molB气体,2min末反应达到平衡状态,生成1molD,并测得C的浓度为0.5mol/L。由此推断:
xC+2D的体系中,若一开始在体系中冲入3molA和3molB气体,2min末反应达到平衡状态,生成1molD,并测得C的浓度为0.5mol/L。由此推断:
-
(1) x值等于。
-
(2) 平衡时B的浓度为。
-
(3) 生成D的反应速率。
-
(4) 试计算反应前和平衡时气体压强之比为:。

 3C(g)+D(s)的影响,乙的压强大
D . 根据图④可判断可逆反应A2(g)+3B2(g)
3C(g)+D(s)的影响,乙的压强大
D . 根据图④可判断可逆反应A2(g)+3B2(g)  2AB3(g)的化学平衡常数K随温度升高而变小
2AB3(g)的化学平衡常数K随温度升高而变小
 CH3OH(g)+H2O(g)。在体积为2 L的密闭容器中,充入2 mol CO2和9 mol H2 , 测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g)。在体积为2 L的密闭容器中,充入2 mol CO2和9 mol H2 , 测得CO2(g)和CH3OH(g)浓度随时间变化如图所示: 
-
(1) 该反应的平衡常数K表达式为。
-
(2) 0~10 min时间内,该反应的平均反应速率v(H2O)=,H2的转化率为。
-
(3) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1452.8 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
-
(4) 下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4NaOH=2Na2CO3+6H2O。

请回答下列问题:
①图中甲、乙两池的名称:甲池是装置,乙池是装置。
②写出电极反应式通入CH3OH的电极的电极反应式是:。
积碳反应:CH4(g)=C(s)+2H2(g)ΔH=+75kJ·mol-1
消碳反应:CO2(g)+C(s)=2CO(g)ΔH=+172kJ·mol-1在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是( )

 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表: | 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是( )
-
(1) 下列诗句、谚语中包含吸热反应的是___________(填字母)。A . 伐薪烧炭南山中 B . 千锤万凿出深山,烈火焚烧若等闲 C . 只要功夫深,铁杵磨成针 D . 冰,水为之,而寒于水
-
(2) 已知
 键的键能是
键的键能是  ,
,  键的键能是
键的键能是  ,
,  键的键能是
键的键能是  。则反应
。则反应  吸收或放出的能量为
吸收或放出的能量为  。在如图中画出该反应过程中能量的变化趋势。
。在如图中画出该反应过程中能量的变化趋势。 
-
(3) 一定温度下,在
 的密闭容器中加入
的密闭容器中加入  和
和  发生反应
发生反应  ,
,  末测知容器中生成了
末测知容器中生成了  。反应开始至
。反应开始至  末,用
末,用  表示的平均反应速率为
表示的平均反应速率为  。下列叙述能说明该反应已达到最大限度的是(填字母)。
。下列叙述能说明该反应已达到最大限度的是(填字母)。 A.
 全部转化为
全部转化为  B.正、逆反应速率相等且均为零
B.正、逆反应速率相等且均为零C.
 和
和  以1∶1的物质的量之比反应生成
以1∶1的物质的量之比反应生成  D.
D.  的物质的量浓度不再变化
的物质的量浓度不再变化

-
(1) 为探究温度对化学反应速率的影响,应选择实验(填序号,下同) ,选择的依据是。
-
(2) 为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验。
-
(3) 通过观察发现实验⑤比实验③现象明显,其原因是。
-
(4) 根据上述实验,用H2O2快速制取少量O2 , 可采取的三条措施为。
 的四氯化碳溶液(
的四氯化碳溶液(  )中发生分解反应:
)中发生分解反应:  。在不同时刻测量放出的
。在不同时刻测量放出的  体积,换算成
体积,换算成  浓度如下表:
浓度如下表: | | 0 | 600 | 1200 | 1710 | 2220 | 2820 | x |
| | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | 0.12 |
下列说法正确的是( )
 ,生成
,生成  的平均速率为
的平均速率为  B . 反应
B . 反应  时,放出的
时,放出的  体积为
体积为  (标准状况)
C . 反应达到平衡时,
(标准状况)
C . 反应达到平衡时,  D . 推测上表中的x为3930
D . 推测上表中的x为3930
 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
-
(1) 已知相关物质的燃烧热(25℃、101kPa):
物质
CH4(g)
CO(g)
H2(g)
燃烧热(ΔH/kJ·mol-1)
-890.3
-283.0
-285.8
则CH4—CO2催化重整反应的ΔH=kJ·mol-1。
-
(2) 将原料按初始组成n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系如图所示。

①T1℃、100kPa下,n(平衡时气体):n(初始气体)=;该温度下,此反应的平衡常数Kp=(kPa)2(以分压表示,列出计算式)。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,点对应的平衡常数最小,理由是;点对应压强最大,理由是。
-
(3) 900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75min后CH4转化率与炭催化剂目数的关系为,原因是。
 分解速率的影响,得到如下数据。由此不能得出的结论是: ( )
分解速率的影响,得到如下数据。由此不能得出的结论是: ( ) | 序号 | Ⅰ | Ⅱ | Ⅲ | ||||||
| 酸碱性 | 中性 | 中性 | 碱性 | ||||||
| /℃ | 95 | 95 | 50 | ||||||
| 反应时间/h | 1 | 3 | 1 | ||||||
| 催化剂(等量) | 无 | | | 无 | | | 无 | | |
| 分解百分率(%) | 0.8 | 57.4 | 2.6 | 1.1 | 96.3 | 4.8 | 35.5 | 100 | 95.0 |
 与
与  对
对  分解都有催化作用,但
分解都有催化作用,但  催化效果更好
B . 由Ⅰ与Ⅱ可知其它条件相同时,时间越长,
催化效果更好
B . 由Ⅰ与Ⅱ可知其它条件相同时,时间越长,  分解越彻底
C . 由Ⅰ与Ⅲ可知其它条件相同时,温度越高,
分解越彻底
C . 由Ⅰ与Ⅲ可知其它条件相同时,温度越高,  分解越快
D . 由Ⅰ与Ⅲ可知其它条件相同时,碱性越强,
分解越快
D . 由Ⅰ与Ⅲ可知其它条件相同时,碱性越强,  分解越快
分解越快
-
(1) 实验一:取
 的
的  溶液各10mL分别进行下列实验,实验报告如下表所示。
溶液各10mL分别进行下列实验,实验报告如下表所示。
序号
V(过氧化氢溶液)/mL
V(氯化铁溶液)/mL
二氧化锰质量/g
反应温度/℃
V(水)/mL
结论
1
10
2
0
50
8
2
10
2
0
30
8
3
10
0
1
30
a
①实验1、2研究的是对
 分解速率的影响。
分解速率的影响。②表中数据a的值应该为;实验2、3研究的是对
 分解速率的影响。
分解速率的影响。③如果实验3中30s时共收集到气体的体积为11.2mL(已折算成标准状况下),则用过氧化氢表示的0~30s的平均反应速率为
 。
。 -
(2) 实验二:已知
 对
对  分解也具有催化作用,为比较
分解也具有催化作用,为比较  和
和  对
对  分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。
分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。

①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是。
-
(3) 实验三:取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中
 前,B试管中产生气体的速率较慢且量少的原因可能为,
前,B试管中产生气体的速率较慢且量少的原因可能为,  后,B试管中产生气体的速率较快且量多的原因可能为。
后,B试管中产生气体的速率较快且量多的原因可能为。

 N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/(mol·L-1) |
10.0 |
8.0 |
7.0 |
6.2 |
4.0 |
4.0 |
|
c(CO)/(mol·L-1) |
8.0 |
6.0 |
5.0 |
4.2 |
2.0 |
2.0 |
-
(1) 前2s内的平均反应速率v(N2)=。
-
(2) 反应达到平衡时CO的转化率为。
-
(3) 下列条件的改变能使上述反应的速率加快的是___(填字母)。A . 降低温度 B . 充入He C . 移走部分CO D . 使用催化剂
-
(4) 能说明上述反应达到平衡状态的是___(填字母)。A . n(CO2)=2n(N2) B . 混合气体的平均相对分子质量不变 C . 气体密度不变 D . 容器内气体压强不变
-
(5) 平衡时容器内压强为P平 , 开始时压强为P始 , 则P平∶P始=。
 和
和 , 发生反应:CO2(g)+3H2(g)
, 发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。回答下列问题:
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。回答下列问题:
-
(1) 3min后,反应达到平衡状态,此时测得反应前后的总压强之比为5∶4。
①
 mol/L,
mol/L, 的转化率为%。
的转化率为%。②

 。
。③该反应达到平衡时的平衡常数K=(列出计算式即可)
 。
。 -
(2) 在一定条件下,体系中的CO2的平衡转化率(
 )与温度(T)和压强(p)的关系如图所示。则T1(填“>”或“<”)T2 , 判断的理由是。
)与温度(T)和压强(p)的关系如图所示。则T1(填“>”或“<”)T2 , 判断的理由是。
 的催化剂可用于汽车尾气脱硝。催化机理如图甲,反应历程如图乙。下列说法正确的是( )
的催化剂可用于汽车尾气脱硝。催化机理如图甲,反应历程如图乙。下列说法正确的是( ) 

 可加快脱硝速率,提高脱硝的平衡转化率
B . 状态③到状态④的变化过程为图示反应的决速步骤
C . 升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度
D . 当有
可加快脱硝速率,提高脱硝的平衡转化率
B . 状态③到状态④的变化过程为图示反应的决速步骤
C . 升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度
D . 当有  消耗时,状态④到状态⑤的变化过程中转移的电子为
消耗时,状态④到状态⑤的变化过程中转移的电子为 
- 中央经济工作会议12日至14日在北京举行,2012年经济工作的总基调是 。 A 积极发展
- 下列实验现象描述错误的是() A.红磷燃烧产生大量白烟 B.点燃镁条发出耀眼的白光 C.生石灰与水反应放出热量 D.细铁
- 某元素R的气态氢化物的相对分子质量为34,最高价氧化物的相对分子质量为80。求该元素的气态氢化物和最高价氧化物的化学式。
- 最近科学家用钙原子轰击锫原子,合成117号元素(部分信息如图所示)。下列说法不正确的是 A.钙和锫都属于金属元素 B.该
- 工业上生产乙烯最主要的途径是( ) A.乙炔加氢 B.乙醇脱水
- 小肠与其吸收功能相适应的结构特点是( ) ①小肠长5—6米
- 的倒数是( ). (A)3 (B)一3 (C) (D)
- 调查机构A C尼尔森最新研究显示,63%的中国网民曾在网上购物。随着网民的急剧增长,中国正成为网上购物的大市场。网络购物
- Myfriend didn’t help me . ________, she laughed at me.A. Ins
- The old man received a lot of respect for his ________ chara
- 对可逆反应:2A(g) + B(s) 3C(s) + 2D(g);ΔH﹤0 下图所示为正逆反应速率(v)与时间(t)关
- 如图的几何体是由四个大小相同的小正方体拼成,则这个几何体的左视图是( ). 从正面看
- 热传导的方向性是指( ) A.热量只能从高温物体传递到低温物体,而不能从低温物体传递到高温物体 B.热量只能从低温
- 阅读下面的文字,完成6~8题。 “厚德载物”的当下价值 “厚德载物”作为中华美德的一种概括,历来
- 已知两条线段的长分别为3 cm和4 cm,当第三条线段的长为___ _cm时,这三条线段能组成一个直角三角形.
- 在平面直角坐标系中,点P(2,—3)关于原点对称的点的坐标是A.(2,3) B.(—2,3) C.(—2,
- 74. All the nations should put _____ the misunderstanding be
- 如图,四棱锥中,侧面是边长为2的正三角形,且与底面垂直,底面是的菱形, 为的中点. (Ⅰ)求与底面所成角的大小; (Ⅱ)
- 分解因式:= .
- 已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气。下列叙述正确的是A.LiH的水溶液呈中性





