课题2 人工固氮技术——合成氨 知识点题库
如图是有关氮的循环示意图.

(1)过程①中通过的作用将空气中的氮气固定下来.
(2)请写出②中合成氨反应的化学方程式: .
(3)请写出③中固氮反应的方程式: .
(4)过程④中的亚硝酸盐有毒,工业上若直接排放将造成对环境的污染.已知NaNO2遇到还原性较强的NH4+等被还原为N2 . 在废液中加入下列物质不能使NaNO2无害化排放的是 .
a.H2O2 b.NH4Cl c.KNO3 .
氮是大气中含量最多的一种元素,氮及其化合物在生产、生活中有着重要作用.请回答:
(1)下列变化属于“氮的固定”的是 (填字母)
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
(2)据报道,意大利科学家获得了极具研究价值的N4 , 其分子结构如图1所示.
已知Ⅰ.断裂1mol N﹣N键吸收167kJ热量,形成1mol N≡N键放出942kJ热量,
Ⅱ.N2 (g)+3H2(g)2NH3(g)△H=﹣92.2kJ•mol﹣1则:N4 (g)+6H2 (g)4NH3(g)△H= kJ•mol﹣1
(3)图2是工业生产硝酸的流程.
①1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:

 、
、 、
、 分别表示N2、H2、NH3 . 图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程 .
分别表示N2、H2、NH3 . 图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程 .
②合成塔中发生反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.2kJ•mol﹣1 , 该反应的化学平衡常数表达式K= .在一定温度和压强下,将H2和N2按3:1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为 .
③吸收塔中通入空气的目的是 .

 2NH3
B . 铝:2Al2O3(熔融)
2NH3
B . 铝:2Al2O3(熔融) 4Al+3O2↑
C . 氯气:MnO2+4HCl(浓)
4Al+3O2↑
C . 氯气:MnO2+4HCl(浓)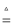 MnCl2+Cl2↑+2H2O
D . 硫酸:2SO2+O2
MnCl2+Cl2↑+2H2O
D . 硫酸:2SO2+O2 2SO3 , SO3+H2O═H2SO4
2SO3 , SO3+H2O═H2SO4
-
(1) 我国化工专家侯德榜做出的突出贡献是
A.海水淡化 B.联合制碱 C.合成材料 D.金属冶炼
-
(2) 关于合成氨工业的说法不正确的是
A.常用铁触媒提高反应速率 B.原料气中的氮气来源于空气
C.通过冷凝把氨从混合气中分离出来 D.降低压强有利于氨的合成
-
(3) 下列有关工业生产的叙述中,不正确的是
A.高炉炼铁时用焦炭作氧化剂 B.添加必要的元素可提高钢材的性能
C.催化裂化可提高汽油的产量 D.电解氧化铝时用冰晶石降低其熔点
-
(4) 工业上用电解法冶炼铝时,析出铝的电极是
A.正极 B.负极 C.阴极 D.阳极.

下列说法正确的是( )
![]()

-
(1) 反应物在催化剂表面的吸附过程是 (填“吸热”或“放热”)。
-
(2) 合成氨的热化学方程式为。升温该反应的平衡常数(填“增大”或“减小”)。
-
(3) t ℃时,向2 L的恒容密闭容器中充入2 mol N2和6 mol H2 , 反应过程中对NH3的物质的量进行监测,得到的数据如表所示:
时间/min
5
10
15
20
25
30
n(NH3)/mol
1.4
2.0
2.4
2.6
2.6
2.6
①10 min内,消耗N2的平均反应速率为,该温度下反应的化学平衡常数K=(mol·L-1)-2(列出计算式即可)。
②若改变某一条件,达到新平衡时使NH3的体积分数增大,下列措施可行的是。
A.向容器中再通入一定量的H2气体
B.升高容器的温度
C.加入合适的催化剂
D.缩小容器的体积
③当上述反应达到平衡后,只改变某一条件,下列措施能提高N2转化率的是。
A.将混合气体降温使氨气液化
B.按原物质的量之比1∶3再通入一定量的N2和H2
C.通入一定量的N2
D.通入一定量的惰性气体

-
(1) 天然气中的H2S杂质常用氨水吸收,写出足量的H2S与氨水反应的化学方程式:。
-
(2) 步骤II中制氢气的原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为。
-
(3) 下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数。

-
(4) 依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

-
(5) 上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)。简述本流程中提高合成氨原料总转化率的方法。
-
(1) 研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
催化剂
Ru
Rh
Ni
Pt
Pd
Fe
初始速率
7. 9
4.0
3.0
2.2
1.8
0.5
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2 mol NH3 , 此时压强为p0 , 用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压p总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压p总×体积分数) -
(2) 关于合成氨工艺的理解,下列说法错误的是(填标号)。
A合成氨工业常采用的反应温度为500 ℃左右,主要是为了节约能源
B使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C合成氨工业采用的压强为10 MPa~30 MPa,是因为常压下N2和H2的转化率不高
-
(3) 在1 L1 mol/L盐酸中缓缓通入2 mol氨气,请在图1中画出溶液中水电离出的OH-浓度随通入氨气的物质的量变化的趋势图。

-
(4) 电化学法合成氨:图2是用低温固体质子导体作电解质,

用Pt- CN,作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:。
 C . 氮气是工业合成氨的原料之一
D . 氮的固定是将大气中的氮气转化成氮的化合物
C . 氮气是工业合成氨的原料之一
D . 氮的固定是将大气中的氮气转化成氮的化合物

下列关于合成氨反应的叙述中错误的是( )

-
(1) 题图所示的氮循环中,属于氮的固定的有(填字母)。
a.反硝化过程 b.硝化过程 c.
 转化为
转化为
-
(2) 农业生产过程中使用的铵态氮肥,是水体中铵态氮元素的来源之一、
①检验某氮肥样品中是否存在
 的实验方法是。
的实验方法是。②实验室制备少量氨气反应的化学方程式为。
-
(3) 铵态氮(
 )与亚硝态氮(
)与亚硝态氮( )在氨氧化细菌的作用下反应生成氮气,若产生
)在氨氧化细菌的作用下反应生成氮气,若产生 氮气,则转移电子的物质的量为
氮气,则转移电子的物质的量为 。
。
-
(4) 题图所示土壤中的铁循环可用于水体脱氮(将氮元素从水体中除去),用离子方程式表示利用土壤中的铁循环脱除水体中铵态氮的原理:。
-
(5)
 与硝态氮(
与硝态氮( )反应脱氮生成
)反应脱氮生成 , 反应后的溶液为
, 反应后的溶液为 和
和 的混合溶液。为检验溶液中含有
的混合溶液。为检验溶液中含有 和
和 , 相应的实验方案为(实验中可选用的试剂:
, 相应的实验方案为(实验中可选用的试剂: 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。
 表面可发生:
表面可发生:
 。关于该过程的说法正确的是( )
。关于该过程的说法正确的是( )
- 计算:
- 日本对敌后抗日根据地进行大“扫荡”,主要是为了 ( ) A.分割、压缩根据地 B.摧毁抗日军民的生存
- 近年来一些手机厂商纷纷发布自己的可折叠手机。化学物质吡唑啉是生产折叠手机用到的柔性屏幕的重要物质,其化学式为C3H6N2
- 向盛有碘化钾溶液的试管中,加入少量氯水和四氯化碳后,充分振荡,可观察到 A.上层液体为紫色,下层液体为无色 B.上层液体
- 下列选项中与成语“刻舟求剑”包含相同哲学思想的是 A.万物都在运动,但只是在概念中运动 B.飞矢
- 下列各句中,加点的成语使用恰当的一项是(3分) A.他是个才思敏捷、勤于思考、喜欢钻研的学生,尤以理科见长,同学们一般都
- 溴元素的原子结构示意图及其在周期表中的信息如图所示.下列说法错误的是()A.n=5 B.该元素为非金属元素 C.形成的
- “嫦娥二号”卫星发射时,长征三号丙火箭直接将卫星由绕地轨道送入200km~38×104km的椭圆奔月轨道,减少了多次变轨
- 我国青铜文化的灿烂时期出现在 A.夏朝 B.商朝
- 下列关于人和高等动物机体代谢及调节的相关叙述,正确的是A.多余的糖可以转化为非必需氨基酸,而多余的氨基酸可以贮存B.脂肪
- 新华网2008年9月28日电 中继卫星“天链一号”顺利完成发射成功后的实验应用,从中继卫星传下来的画面能够清晰看到“神七
- 电视连续剧《沂蒙》是临沂继大型红色水上实景演出《蒙山沂水》.电影《沂蒙六姐妹》后推出的一部文艺精品 ,其播出掀起收视热潮
- 1952年底我国已基本完成了土地改革,至此确立了( ) A. 生产资料公有制 B.人民公社
- 阅读下面一段文言文,完成1-6题 吴士好夸言。自高其能,谓举世莫及。尤善言兵,谈必推孙吴。遇元季乱,张士诚称王姑苏,与国
- 下列变化的实质相似的是() ①浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字 ②二氧化硫和氯气均能使品红溶液褪色 ③二氧化硫
- 如图所示,乌鸦后一年的种群数量是前一年的λ倍,下列分析正确的是()A.第6年以前乌鸦种群呈“S”型增长 B.第5年和第7
- 下列表示北京的四幅图中,地图比例尺最小的是 ( )
- 下列说法中,其中正确的是( ▲ )A.对于给定的一组数据,它的众数可以不只一个B.有两边相等且一角为的两个等腰三角形全等
- 某同学在测量电源电动势和内电阻的实验时根据自己测量的数据做出如图(a)所示的图象,从图象可知该同学测量的电源电动势为
- 下列物质中,在一定条件下既能发生水解反应,又能发生银镜反应的是( ) A.蔗糖 B.葡萄糖



