课题2 人工固氮技术——合成氨 知识点题库
[Cu(NH3)2Ac]+CO+NH3 [Cu(NH3)3]Ac·CO+Q
[Cu(NH3)3]Ac·CO+Q
-
(1) 必须除去原料气中CO的原因是?
-
(2) 醋酸二氨合铜(l)吸收CO的适宜条件是。
-
(3) 吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,醋酸铜氨液再生的适宜条件是。

①请写出用天然气制备氢气的化学方程式: .
②写出合成尿素反应的化学方程式: .
③写出O2与NH3反应生成NH4NO3和H2O的化学方程式: .
④每生产1mol NH4NO3最少需要NH3 mol,而要生产这些NH3又最少需要CH4 mol.
(2)科学家已获得极具理论研究意义的N4分子,其结构为正四面体(如图2).已知断裂1molN﹣N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要释放 kJ能量.
(1)下面是利用氮气的一种途径

①步骤I中主要利用N2与液态空气中其它成分的 (填性质)不同.
②步骤II在自然界大气中发生反应的化学方程式为 .
③最新研究发现在碱性溶液中通过电解反应2N2+6H2O 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为 .
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为 .
(2)氨气可以用于侯氏制碱法,其流程如图所示:

①循环Ⅰ、Ⅱ中循环利用的物质X是 ,Y是 .(填化学式)
②向沉淀池中通入气体时,需要先通入NH3 , 再通入CO2 , 其原因是 .
(3)尿素【CO(NH2)2】是氮的一种重要化合物,可用于除去酸性工业废水中的NO2﹣ , 生成的产物无污染,反应的离子方程式为 ;该反应生成6.72L(已折算为标准状况)混合气体时,消耗尿素的质量为 .

依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是 .
(2)图中CH4的第一次转化过程中的化学方程式是 .
(3)整个流程有三处循环,一是K2CO3(aq)循环,二是N2和H2循环,三是 (填化学式)循环.
(4)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分).
a.熵增原理 b.勒夏特列原理 c.酸碱中和原理.

①写出工业合成氨的化学方程式,上述尾气中的NO一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为.
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有.
 与
与  反应生成
反应生成  C .
C .  和
和  反应生成
反应生成  D .
D .  和
和  在一定条件下合成氨
在一定条件下合成氨
-
(1) 化学家
 证实了氢气与氮气在固体催化剂表面合成氨的过程,示意图如下:
证实了氢气与氮气在固体催化剂表面合成氨的过程,示意图如下: 




下列说法正确的是____________(填标号)。
A . ①表示 分子中均是单键
B . ②→③需要吸收能量
C . ③→④需要吸收能量
D . 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
分子中均是单键
B . ②→③需要吸收能量
C . ③→④需要吸收能量
D . 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
-
(2) 合成氨反应在不同压强、使用相同催化剂条件下,初始时氮气和氢气的体积比为
 时,平衡时混合物中氨的体积分数
时,平衡时混合物中氨的体积分数  与温度的变化关系如图所示。
与温度的变化关系如图所示。 
①若分别用
 和
和  表示从反应开始至达到平衡状态A、B时的化学反应速率,则
表示从反应开始至达到平衡状态A、B时的化学反应速率,则  (填“>”“<”或“=”)
(填“>”“<”或“=”)  。
。②在250℃、
 时,
时,  的转化率为(结果保留三位有效数字)%。
的转化率为(结果保留三位有效数字)%。 -
(3) 温度为
 时,在
时,在  的恒容密闭容器中加入
的恒容密闭容器中加入  ,此时压强为
,此时压强为  ,用
,用  催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应
催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应  ,用平衡分压代替平衡浓度表示的化学平衡常数
,用平衡分压代替平衡浓度表示的化学平衡常数  (用含
(用含  的代数式表示)。[已知:气体分压
的代数式表示)。[已知:气体分压  气体总压
气体总压  体积分数]
体积分数]
-
(4) 液氨是一种良好的储氢物质,液氨的电离与水的电离相似:
 ,常温下
,常温下  ,常温下,将一定量的金属钠投入
,常温下,将一定量的金属钠投入  液氨中,待反应结束后,收集到标准状况下
液氨中,待反应结束后,收集到标准状况下  氢气。忽略溶液体积的变化,则恢复到室温时所得溶液中
氢气。忽略溶液体积的变化,则恢复到室温时所得溶液中 
 。
。
-
(5) 在一定条件下,可用
 消除
消除  污染,其反应原理为
污染,其反应原理为  (1)
(1)  。在刚性容器中,
。在刚性容器中,  与
与  的起始物质的量之比分别为X、Y、Z(其中
的起始物质的量之比分别为X、Y、Z(其中  ),在相同时间内不同温度条件下,得到
),在相同时间内不同温度条件下,得到  的脱除率(即
的脱除率(即  的转化率)曲线如图所示。
的转化率)曲线如图所示。 ①
 与
与  的物质的量之比为
的物质的量之比为 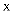 时对应的曲线为(填“a”“b”或“c”)。
时对应的曲线为(填“a”“b”或“c”)。②各曲线中
 的脱除率均先升高后降低的原因为。
的脱除率均先升高后降低的原因为。
 2NH3(g)ΔH<0。下列说法正确的是( )
2NH3(g)ΔH<0。下列说法正确的是( )
选项 | 劳动项目 | 化学知识 |
A | 社区服务:回收旧衣物并进行分类 | 棉、麻和丝主要成分均为纤维素 |
B | 家务劳动:用热的纯碱溶液去除餐具的油污 | 碳酸钠溶液显碱性 |
C | 校内劳动:用稀硝酸处理做过银镜反应的试管 | 硝酸具有强氧化性 |
D | 学农活动:利用豆科植物作绿肥进行施肥 | 豆科植物可实现自然固氮 |
-
(1) 下列有关获取原料气的说法正确的是___________。A . 可通过液化空气分离法得到氮气 B . 可用煤、天然气与水蒸气反应制备水煤气,进而获取氢气 C . 原料气需经净化处理以防催化剂中毒 D . 电解水法获取氢气是一种较为廉价且高效的方法
-
(2) 原料气中的杂质气体H2S可用过量氨水净化吸收,写出化学反应方程式。
-
(3) 工业生产中氮气与氢气按物质的量之比为1:2.8进行投料,合成塔压强p恒定。若起始时氮气通入量为xmol,一段时间后测得氮气的平衡转化率为80%,用平衡分压代替平衡浓度表示平衡常数的KP=(用p表示,气体分压=总压ⅹ物质的量分数)
-
(4) 据统计,每年全世界在合成氨工业中向外排放CO2高达40亿吨,为循环使用CO2减少浪费,常见的方法是利用合成氨的产品NH3和副产品CO2合成尿素:
①2NH3(g)+CO2(g)
 NH2COONH4(l)
NH2COONH4(l)  Ea1
Ea1②NH2COONH4(l)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  Ea2
Ea2副反应:NH2COONH4+H2O=(NH4)2CO3
已知活化能大小:Ea1<<Ea2
某科研小组模拟工业合成尿素生产,发现反应温度在140℃时生成尿素的反应速率反而比80℃小,可能原因是。
-
(5) 工业合成尿素中,通常氨碳投料比大于2,请分析可能原因___________。A . 氨易获得,成本较低 B . 氨过剩可提高二氧化碳的转化率,加快合成速率 C . 氨气可与体系内水结合,减少氨基甲酸铵水解,抑制副反应发生 D . 氨结合水,促进反应②正向移动
- ,把酒话桑麻。(《过故人庄》)
- 假如你叫李华,有一位来自英国的朋友Mike。他与父母一道来到了中国。初来乍到,他发现自己在家时所学的汉语根本就不够用。因
- Everyone wantsto be self-confident, but maybe we just don’t
- Mrs Black isn’t in and I’ll have to ring ______. I would app
- 下列关于染色体、DNA、基因三者之间的关系,正确的表达图示是( )
- 针对日益严重的资源浪费现状,中央领导同志做出关于“厉行勤俭节约,反对铺张浪费”的重要批示,在全国各地产生了极大影响。中央
- 14、学者周锡瑞指出辛亥革命后“任官举职,权柄恒不白上。往往司长所辟除者,地方人民辄投函或径谒司长,要求更易,甚至已易数
- 阅读下列材料 材料一 为了巩固“遏制”苏联等社会主义国家,美国在推行马歇尔计划的同时,还积极策动西方资本主义国家建
- 有9 名翻译人员,其中6人只能做英语翻译,2人只能做韩语翻译,另外1人既可做英语翻译也可做韩语翻译.要从中选5人分别接待
- (5分)化学就在我们身边,它与我们的生产、生活息息相关。从石灰石、金刚石、氢氧化钠、干冰、小苏打五种物质中,选择与下列用
- 下列对mRNA的描述,不正确的是() A.mRNA可作为合成蛋白质的直接模板 B.mRNA上的三个相邻的碱基能决定一个氨
- 在实验活动1《氧气的实验室制取与性质》中,下列与试管有关的操作或装置(试剂 和酒精灯省略)的图示正确的是
- 21.阅读下面的材料,根据要求写一篇不少于800字的文章。 在一次以“诗词影响生活”为主题的读书交流活动中,同学们各抒己
- 3.下列各句中加点词语的使用,不恰当的一项是 A.“2015年度中国文化跨界论坛“日前在北京举行,届时来自世界各国的艺术
- (1)念高危,______________;惧满溢,____________。(魏征《谏太宗十思疏》) (2)最是
- 取三个干燥的烧瓶,分别装入标准状况下的含1/4体积空气的NH3、含有1/3体积空气的HCl、NO和O2(体积比4∶3)的
- 3.填入下面一段文字横线处的语句,最恰当的一句是( ) 从草木虫鱼的生活,我得出一个经验。我不在生活以外别求生活方法,
- 我国新修订的《环境空气质量标准》增加了PM2.5监测指标。PM2.5(particulatematter)是指2.5微米
- 县、乡两级人大代表选举在全国各地有序展开,广大选民踊跃参与,投出自己神圣的一票。这反映了A.人民代表大会制度是我国的根本
- 不能用水浴加热的实验是 A.苯的硝化反应



