相似相溶原理及其应用 知识点题库
| 选项 | 实验事实 | 理论解释 |
| A | 碘单质在 CCl4 中溶解度比在水中大 | CCl4 和 I2 都是非极性分子, 而 H2O 是极性分子 |
| B | CO2 为直线形分子 | CO2 分子中 C═O 是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF 的沸点高于 HCl | HF 的相对分子质量小于 HCl |

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,试回答:
-
(1) 写出H2O2分子的电子式和结构式。
-
(2) 写出分子内的键型。
-
(3) 估计它难溶于CS2 , 简要说明原因。
-
(4) 指出氧元素的化合价,简要说明原因。

 )分子中含有一个手性碳原子
C . 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D . 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
)分子中含有一个手性碳原子
C . 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D . 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
| 目的 | 操作 | |
| A | 鉴别 | 光束分别通过两种分散系 |
| B | 清洗碘升华实验所用试管 | 用水清洗 |
| C | 测定醋酸钠溶液 | 用玻璃棒醮取溶液,点在湿润的 |
| D | 配制浓度为 | 称取 |
回答下列问题:
-
(1) 金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用“理论”解释。
-
(2) SiO2硬而脆,其原因是。
-
(3) Ca、Fe、K、Zn的第一电离能由大到小的顺序为。
-
(4) O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是 (填化学式);P4难溶于水却易溶于CS2 , 其原因为。
-
(5) PO
 的空间构型为,酸性条件下,PO
的空间构型为,酸性条件下,PO  可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+ , 基态Fe3+核外M层有种空间运动状态不同的电子。
可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+ , 基态Fe3+核外M层有种空间运动状态不同的电子。
-
(1) 铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是(填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
-
(2) 砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为。
-
(3) 英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是,石墨烯导电的原因是。

-
(4) 石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
物质
六氯苯

六溴苯

苯六酸

熔点/℃
231
325
287
水溶性
不溶
不溶
易溶
六溴苯的熔点比六氯苯高的原因是,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是。
-
(5) 出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为g·cm-3。(NA是阿伏加德罗常数的值,相关原子量:Nb—93)

选项 | 实验事实 | 理论解释 |
A | 环状S8分子结构如图 | S原子采取的杂化方式为sp3 |
B | SO2易溶于水而难溶于CCl4 | SO2和水都是极性分子而CCl4为非极性分子 |
C | HF分子热稳定性比HCl强 | HF分子间作用力比HCl强 |
D | Fe2+比Fe3+的稳定性小 | Fe2+和Fe3+的价电子排布式分别为3d6、3d5 , Fe3+的3d能级为半充满的稳定结构 |
选项 | 实验事实 | 理论解释 |
A |
|
|
B |
|
|
C | 酸性: |
|
D |
|
|
 Na+(NH3)x+e-(NH3)y , 下列说法错误的是( )
Na+(NH3)x+e-(NH3)y , 下列说法错误的是( )
 C . e-(NH3)y具有强还原性,钠/液氨体系可以还原炔烃、苯等有机物
D . e-(NH3)y在液氨体系中会产生H2
C . e-(NH3)y具有强还原性,钠/液氨体系可以还原炔烃、苯等有机物
D . e-(NH3)y在液氨体系中会产生H2
选项 | 事实 | 解释 |
A | SiO2的熔点比干冰高 | SiO2晶体是共价晶体,分子间作用力大 |
B | 在CS2中的溶解度:CCl4 >H2O | CS2、CCl4为非极性分子,而H2O为极性分子 |
C | 用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰 | 两个乙酸分子通过范德华力形成了二聚体 |
D | 离子液体有难挥发性 | 离子液体的粒子全都是带电荷的离子 |

-
(1) 仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,仪器a中产生的现象为。
-
(2) 与普通分液漏斗相比,仪器b的优点是。
-
(3) 仪器d内盛有苯、FeCl3粉末,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e是洗气瓶,瓶内盛装的试剂是;
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好采用加热。
-
(4) 仪器c的作用是;d中发生反应的化学方程式是。
-
(5) 该方法制备的氯苯中含有很多杂质,工业生产中通过水洗、碱洗、再水洗,最后通过分液得到含氯苯的混合物,该混合物的成分及各成分的沸点如下表所示:
有机物
苯
氯苯
邻二氯苯
间二氯苯
对二氯苯
沸点/℃
80
132.2
180.4
172.0
173.4
①碱洗前先进行水洗的目的是;
②提取该混合物中的氯苯时,采用蒸馏的方法,收集℃左右的馏分。
- .(13分)阅读下列材料:材料一 ……
- 图甲为反射弧的结构示意图,图乙、图丙为图
- 占干洁空气容积中99%的是 A、氮和氢 B、氮和
- 美国1787年宪法和1871年《德意志帝国宪法》的
- 在国家财政收入主要来源的国有经济中贡献最
- 下图表示30°N~60°N的大陆部分,读图回答下
- 《中国海洋报》2008年1月23日报道,由于全球
- X、Y、Z为三种短周期元素,X、Y处在相邻的两
- 设成立,可得, 由此推得 .
- 自身免疫病产生的原因是A.人体免疫系统对
- (本小题满分8分) 某社区从不同住宅楼中随
- 有氧呼吸产生ATP最多的阶段是A.葡萄糖分解
- On your way to New York William will keep you ______if you d
- 我国名酒五粮液素有“三杯下肚浑身爽,一滴
- 清朝著名思想家顾炎武说:“不廉则无所不取
- 下列物质中同时含有磷和氮元素的是( )
- 图所示现象,是水的 能转化为塞子的
- 在(x+ )的展开式中,系数为有理数的项共有
- 阅读下面的文言文,完成后面题目。 文学徐
- 已知椭圆的左右焦点分别为F1,F2,若过点P(0
 溶液和
溶液和 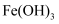 胶体
胶体
 的
的  溶液
溶液 ,放入
,放入  容量瓶中,加水溶解并稀释至刻度
容量瓶中,加水溶解并稀释至刻度
 的熔点高于
的熔点高于
 和
和 都能溶于
都能溶于 溶液
溶液
 中非羟基氧原子个数更多,中心原子的正电性更高
中非羟基氧原子个数更多,中心原子的正电性更高 在苯中的溶解度比在水中大
在苯中的溶解度比在水中大 是极性分子
是极性分子


