金属键 知识点题库
某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线.当玻璃被击碎时,与金属线相连的警报系统就会立即报警.“防盗玻璃”能报警是利用了金属的( )
A . 延展性
B . 导电性
C . 弹性
D . 导热性
金属能导电的原因是( )
A . 金属晶体中金属阳离子与自由电子间的相互作用较弱
B . 金属晶体中的自由电子在外加电场作用可发生定向移动
C . 金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D . 金属晶体在外加电场作用可失去电子
下列关于金属及金属键的说法正确的是( )
A . 金属键具有方向性与饱和性
B . 金属键是金属阳离子与自由电子间的相互作用
C . 金属导电是因为在外加电场作用下产生自由电子
D . 金属具有光泽是因为金属阳离子吸收并放出可见光
金属的下列性质中,与金属的晶体结构无关的是( )
A . 易导电
B . 易导热
C . 有延展性
D . 易锈蚀
金属具有延展性的原因是( )
A . 金属原子半径都较大,价电子较小
B . 金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用
C . 金属中大量自由电子受外力作用时,运动速度加快
D . 自由电子受外力作用时能迅速传递能量
下面叙述中正确的是( )
A . 金属能导电是因为金属离子在外加电场的作用下发生定向移动
B . 含有金属元素的离子不一定是阳离子
C . 晶格能:NaCl<NaBr
D . 熔点:晶体硅>金刚石
金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽.请在下面金属用途后的横线上填上金属主要性质对应的序号.(每空限选一个)
(1)用铝锭制成包装用的铝箔 ;
(2)用铝制成的高压铝锅 ;
(3)用铁粉回收照相业废液中的银 ;
(4)电信业中大量使用的铜丝、金属电缆
有三种固体物质和五种溶液:固体是铁粉、铜粉、氢氧化铜;溶液是CuSO4溶液、NaOH溶液、FeSO4溶液、H2SO4溶液、Na2SO4溶液.它们中的几种物质在常温下相互转化关系如下:
(1)溶液A+溶液C→固体甲+溶液D
(2)固体乙+溶液B→溶液E+氢气
(3)固体甲+溶液B→溶液C+水
a.试推断溶液中B、C的名称及固体甲的名称.B、 C、 甲、
b.写出反应(3)的化学方程式为
c.其中属于氧化还原反应的是 (填序号)
金属键的形成是通过( )
A . 金属原子与自由电子之间的相互作用
B . 金属离子与自由电子之间强烈的相互作用
C . 自由电子之间的相互作用
D . 金属离子之间的相互作用
金属镍在电池、合金、催化剂等方面应用广泛.
-
(1) 下列关于金属及金属键的说法正确的是.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
-
(2) Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是.
-
(3) 过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=.CO与N2结构相似,CO分子内σ键与π键个数之比为.
-
(4) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为,甲醇分子内的O﹣C﹣H键角(填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
下列关于金属及金属键的说法中正确的是( )
A . 金属键具有方向性与饱和性
B . 金属键是金属阳离子与自由电子间的相互作用
C . 金属导电是因为在外加电场作用下产生自由电子
D . 金属具有光泽是因为金属阳离子吸收并放出可见光
物质结构理论推出:金属键越强,其金属的硬度越大,熔、沸点越高。且研究表明,一般来说,金属阳离子半径越小,所带电荷越多,则金属键越强,由此判断下列说法错误的是( )
A . 硬度:Mg>Al
B . 熔点:Mg>Ca
C . 硬度:Mg>K
D . 熔点:Ca>K
下列关于金属的叙述中不正确的是( )
A . 金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,所以实质与离子键类似,也是一种电性作用
B . 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
C . 金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性
D . 构成金属的自由电子在整个金属内部的三维空间中做自由运动
下列推测正确的是( )
A . Mg2+半径比Ca2+半径小,可推测金属镁的熔点比钙的低
B . Si原子半径比Ge原子半径小,可推测晶体硅的硬度大于晶体锗
C . 某物质在熔融状态下能导电,可推测该物质在固态时为离子晶体
D . N-H键比P-H键牢固,可推测NH3的沸点高于PH3
化学中很多“规律”都可以类推,下列有关“规律”推理正确的( )
A . 铁与氯气反应生成FeCl3 , 则铁与碘蒸气反应生成FeI3
B . CO2通入Ba(NO3)2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀
C . CH4为正四面体分子,则CCl4也为正四面体分子
D . 卤族元素单质随核电荷数增加熔点升高,则碱金属单质熔点也随核电荷数增加而升高
Co、Se、Fe、Cr、Ni、C等元素化合物在生产、生活中应用广泛。回答下列问题:
-
(1) 金属可导电、导热,有金属光泽和延展性,这些性质都可以用“理论”解释。
-
(2) 已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合(选填编号),每个Mn原子周围紧邻的原子数为。
A.
 B.
B.  C.
C.  D.
D. 
-
(3) 无水CoCl2的熔点是735℃,沸点1049℃,CoCl2属于晶体;砷酸
 分子中As原子的杂化方式为杂化。
分子中As原子的杂化方式为杂化。
-
(4) 碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,
 分子占据顶点和面心处,
分子占据顶点和面心处,  占据的是
占据的是  分子围成的正四面体空隙和空隙(填几何空间构型)。
分子围成的正四面体空隙和空隙(填几何空间构型)。 
-
(5) Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+ , 则晶体中Ni2+与Ni3+的最简整数比为,晶胞参数为428pm,则晶体密度为g/cm3(
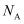 表示阿伏加德罗常数的值,列出表达式)
表示阿伏加德罗常数的值,列出表达式)
钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。
-
(1) 钛在周期表中的位置, 钛原子核外有种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为。
-
(2) 已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是。
-
(3) 硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为, 该晶体中阴离子的空间构型为。

-
(4) Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为,B原子的杂化方式是,其中的BH
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH  含有 (填序号)
含有 (填序号) ①σ键 ②π键 ③氢键 ④配位健 ⑤离子键
-
(5) 单质钛晶体的晶胞结构如图2所示,则钛的这种堆积方式称为, 若钛原子半径为r pm,NA表示阿伏加德罗常数的值,金属钛的密度为g/cm3(列出计算式即可)
下列有关叙述中正确的是( )
A . 任何固体中,若含有阳离子也一定含有阴离子
B . 金属键越强,则该金属的熔点越低
C . 将铁制品做成炊具,金属键没有被破坏
D . 常温下,金属单质都以固态形式存在
下列有关金属键的叙述错误的是( )
A . 金属键没有饱和性和方向性
B . 金属键是金属阳离子和自由电子之间强烈的静电吸引作用
C . 金属键中的自由电子属于整块金属
D . 金属的性质和金属固体的形成都与金属键有关
最近更新
- (4分)某同学根据所学得光学知识,设计了
- 下列关于热学的知识叙述正确的是A.分子间
- 为了保证长时间潜航,在潜水艇里需配备氧
- 某小鼠的癌细胞具有氯霉素抗性,通过细胞
- 太平天国是中国资产阶级民主革命的“准备
- 下列有关基因工程的叙述,正确的是 A.DNA
- 积土成山,风雨兴焉。积水成渊,蛟龙生焉
- 有关细胞结构和功能的叙述,正确的是( ) A
- 已知是椭圆上关于原点对称的两点,是椭圆
- 一次参观活动中,一位同学看到一个零件的
- 阅读下面这首诗 雨过山村 王建 雨里
- 已知铁的比热容小于铝的比热容。质量相同
- 人体内的铁元素以Fe2+和Fe3+的形式存在。正
- 已知函数,则函数的大致图象
- 当代人类的生活和电磁波紧密相关,关于电磁
- 如图,已知在四边形中,与相交于点,AB⊥AC
- 为了测定木块所受到的滑动摩擦力,两个实
- You_______go to the party if you don’t fin
- 设,则的最大值为 ▲ .
- (1)短周期元素X、Y、Z在周期表中的位置关



